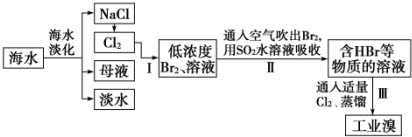
题目内容
7.取一定质量含Fe、FeO、Fe3O4的固体混合物,将其分成两等份,取其中一份用足量氢气还原,测得反应后的固体质量减少mg,另一份加入500mL4.0mol/L的稀硝酸,固体恰好完全溶解且同时收集到标准状况下NO气体4.48L,则m的值为( )| A. | 6.4 | B. | 8 | C. | 3.2 | D. | 9.6 |
分析 NO气体4.48L的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,生成0.2mol的一氧化氮,消耗氢离子的物质的量为:0.2×2×2=0.8mol,而 500mL4.0mol/L的稀硝酸提供氢离子的物质的量为:0.5×4=2mol,则结合固体混合物中的氧的氢离子的物质的量为:2-0.8=1.2mol,所以混合物中氧元素的物质的量为:0.6mol,由此分析解答.
解答 解:NO气体4.48L的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,生成0.2mol的一氧化氮,消耗氢离子的物质的量为:0.2×2×2=0.8mol,而 500mL4.0mol/L的稀硝酸提供氢离子的物质的量为:0.5×4=2mol,则结合固体混合物中的氧的氢离子的物质的量为:2-0.8=1.2mol,所以混合物中氧元素的物质的量为:0.6mol,用足量氢气还原,测得反应后的固体质量减少mg,就是氧元素的物质的量,则m=0.6mol×16g/mol=9.6g,故选D.
点评 本题考查学生利用原子守恒的方法来计算,明确生成1mol的一氧化氮,提供2mol的氧负离子,结合4mol的氢离子这是解题的关键所在,有一定的难度.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.Cl2、SO2和Na2O2都能使品红溶液褪色,下列有关说法正确的是( )
| A. | Na2O2是碱性氧化物,SO2是酸性氧化物 | |
| B. | 分别加热用Cl2、SO2和Na2O2漂白过的品红溶液都能恢复红色 | |
| C. | 将Cl2和SO2同时通入水中能生成两种强电解质 | |
| D. | Cl2、SO2和Na2O2漂白原理相同 |
12.键线式可以简明扼要的表示碳氢化合物, 种键线式物质是( )
种键线式物质是( )
 种键线式物质是( )
种键线式物质是( )| A. | 丁烯 | B. | 丙烷 | C. | 丁烷 | D. | 丙烯 |
19.氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲酸(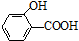 )存在分子内氢键,对羟基苯甲酸 (
)存在分子内氢键,对羟基苯甲酸 ( 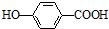 )存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )
)存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )
 )存在分子内氢键,对羟基苯甲酸 (
)存在分子内氢键,对羟基苯甲酸 (  )存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )
)存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )| A. | 前者>后者 | B. | 前者<后者 | C. | 前者=后者 | D. | 无法估计 |

 (1)已知反应:H2+Cl2$→_{400℃}^{CuO/CuCl_{2}}$2HCl,已知H-H键能为436kJ/mol,Cl-Cl键能为243kJ/mol,H-Cl键能为432kJ/mol.
(1)已知反应:H2+Cl2$→_{400℃}^{CuO/CuCl_{2}}$2HCl,已知H-H键能为436kJ/mol,Cl-Cl键能为243kJ/mol,H-Cl键能为432kJ/mol.