题目内容
12.下列说法正确的是( )| A. | 0.1mol•L-1硫化钠溶液中离子浓度关系:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)] | |
| B. | 常温下醋酸分子不可能存在于pH>7的碱性溶液中 | |
| C. | 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中:c(Cl-)>c(NH4+) | |
| D. | 0.1mol•L-1的氯化铵溶液与0.05mol•L-1的氢氧化钠溶液等体积混合后,混合溶液中离子浓度:c(Cl-)>c(NH4+)>c(Na+)>c(H+)>c(OH-) |
分析 A.硫化钠的化学式为Na2S,利用物料守恒来分析;
B.存在醋酸与醋酸钠的混合溶液;
C.利用电荷守恒来分析;
D.0.1mol•L-的氯化铵溶液与0.05mol•L-的氢氧化钠溶液等体积混合后溶液中存在等物质的量的NaCl、NH4Cl、NH3.H2O.
解答 解:A.硫化钠的化学式为Na2S,则0.1mol•L-1硫化钠溶液中离子浓度关系c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),故A正确;
B.在醋酸和醋酸钠的溶液中,若水解大于电离,溶液的pH>7,故B错误;
C.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则c(H+)=c(OH-),由电荷守恒可知,c(H+)+c(NH4+)=c(Cl-)+c(OH-),则c(NH4+)=c(Cl-),故C错误;
D.0.1mol•L-的氯化铵溶液与0.05mol•L-的氢氧化钠溶液等体积混合后溶液中存在等物质的量的NaCl、NH4Cl、NH3.H2O,溶液显碱性,电离大于水解,则c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故D错误;
故选A.
点评 本题考查离子浓度的关系,明确离子浓度的大小于弱电解质的电离、盐类的水解有关,并学会利用电荷守恒、物料守恒来分析解答,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列贮存化学试剂的方法正确的是( )
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 波尔多液(CuSO4与石灰水按一定比例混合)盛放在铁制容器中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 金属钠保存在煤油中 |
17.某元素原子的核外有四个能层,最外能层有1个电子,该原子核内的质子数不可能为( )
| A. | 19 | B. | 24 | C. | 28 | D. | 29 |
4.海水开发利用的部分过程如图所示.下列说法错误的是( )
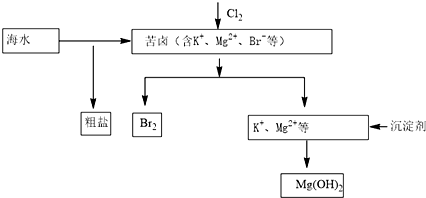

| A. | 工业生产中常选用NaOH作为沉淀剂 | |
| B. | 粗盐可采用溶解、过滤和重结晶等过程进一步提纯 | |
| C. | 向苦卤中通入Cl2是为了提取溴 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
 下列给出了烃及烃的衍生物A、B、C、D、E的相关信息:
下列给出了烃及烃的衍生物A、B、C、D、E的相关信息: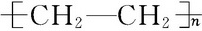 .
.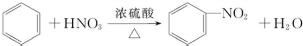
 A、B、C、D、E、F 六种有机物.A能够在光照条件下与氯气发生取代反应,其二氯取代物有两种; B与溴的四氯化碳溶液可以发生加成反应,加成产物是D,且D只有一种同分异构体E;C在FeBr3 的作用下,可以与液溴发生取代反应,取代产物是F,F没有含苯环的同分异构体.根据以上事实,回答下列问题:
A、B、C、D、E、F 六种有机物.A能够在光照条件下与氯气发生取代反应,其二氯取代物有两种; B与溴的四氯化碳溶液可以发生加成反应,加成产物是D,且D只有一种同分异构体E;C在FeBr3 的作用下,可以与液溴发生取代反应,取代产物是F,F没有含苯环的同分异构体.根据以上事实,回答下列问题: ;
;