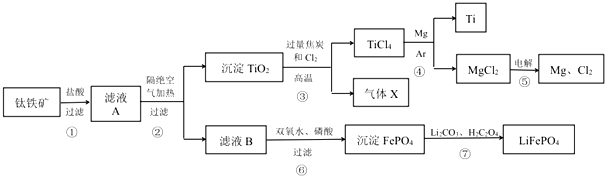
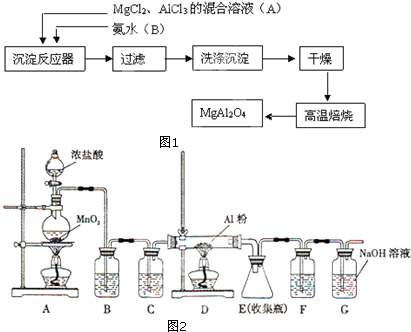
题目内容
19.磺酰氯(SO2Cl2)是一种重要的有机合成试剂,SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,产物之一为氯化氢气体.实验室可利用SO2与氯气反应制取少量的SO2Cl2.装置如图(有些支持装置省略了)所示.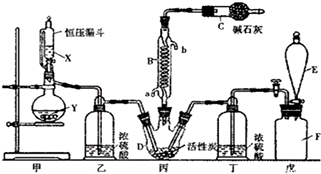
(1)化合物SO2Cl2中S元素的化合价是+6.
(2)仪器E的名称是分液漏斗,由B的使用可知SO2与氯气之间的反应属于放(填“放”或“吸”)热反应,仪器C的作用是吸收逸出都有毒的Cl2、SO2,防止空气中的水蒸气进入C,防止污染环境及磺酰氯水解
(3)试剂X、Y的组合最好是c.(填字母)
a.18.4mol/LH2SO4+Cu b.4mol/LHNO3+Na2SO4 c.60% H2SO4+K2SO3
(4)戊是贮氯气装置,则E中的试剂是饱和食盐水;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的离子方程式是SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(5)反应结束后,将丙中混合物分离开的实验操作是蒸馏.若反应中消耗的氯气的体积为896mL(已转化为标准状况,SO2 足量),最后得到纯净的磺酰氯4.2g,则磺酰氯(相对分子质量:135)的产率为77.8%(保留三位有效数字).
分析 由(4)戊是贮氯气装置,可知甲装置制备二氧化硫,二氧化硫与氯气在丙中反应生成SO2Cl2,丙中活性炭可能起催化剂作用,SO2Cl2遇水发生剧烈的水解反应,乙为干燥二氧化硫,E中盛放溶液加入戊中排出装置内氯气,可以是饱和食盐水,降低氯气溶解度,丁干燥氯气,SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,碱石灰吸收为反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入C中导致磺酰氯水解.
(1)SO2Cl2遇水能发生剧烈的水解反应,产物之一为氯化氢气体,另外生成物质为硫酸,可知硫元素化合价;
(2)由仪器结构特征可知,仪器E为分液漏斗;SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,说明SO2与氯气之间的反应属于放热反应;
(3)甲装置制备二氧化硫,Cu与浓硫酸反应需要加热,稀硝酸与硫酸钠不反应;
(4)E中盛放溶液加入戊中排出装置内氯气,可以是饱和食盐水;潮湿的氯气和二氧化硫反应生成HCl与硫酸;
(5)分离沸点不同的液体可以用蒸馏的方法;计算氯气物质的量,再计算磺酰氯的理论产量,进而计算其产率.
解答 解:由(4)戊是贮氯气装置,可知甲装置制备二氧化硫,二氧化硫与氯气在丙中反应生成SO2Cl2,丙中活性炭可能起催化剂作用,SO2Cl2遇水发生剧烈的水解反应,乙为干燥二氧化硫,E中盛放溶液加入戊中排出装置内氯气,可以是饱和食盐水,降低氯气溶解度,丁干燥氯气,SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,碱石灰吸收为反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入C中导致磺酰氯水解.
(1)SO2Cl2遇水能发生剧烈的水解反应,产物之一为氯化氢气体,另外生成物质为硫酸,可知硫元素化合价+6价,故答案为:+6;
(2)由仪器结构特征可知,仪器E为分液漏斗;SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,说明SO2与氯气之间的反应属于放热反应,仪器C的作用是:吸收逸出都有毒的Cl2、SO2,防止空气中的水蒸气进入C,防止污染环境及磺酰氯水解,
故答案为:分液漏斗;放;吸收逸出都有毒的Cl2、SO2,防止空气中的水蒸气进入C,防止污染环境及磺酰氯水解;
(3)甲装置制备二氧化硫,Cu与浓硫酸反应需要加热,稀硝酸与硫酸钠不反应,60%硫酸与亚硫酸钾不需要加热可以得到二氧化硫,
故选:c;
(4)E中盛放溶液加入戊中排出装置内氯气,可以是饱和食盐水,降低氯气溶解度;潮湿的氯气和二氧化硫反应生成HCl与硫酸,反应离子方程式为:SO2+Cl2+2H2O=4H++SO42-+2Cl-,
故答案为:饱和食盐水;SO2+Cl2+2H2O=4H++SO42-+2Cl-;
(5)分离沸点不同的液体可以用蒸馏的方法,所以丙中混合物分离开的实验操作是蒸馏,标准状况下,896mlCl2为$\frac{0.896L}{22.4L/mol}$=0.04mol,故理论上可得到0.04molSO2Cl2,即为0.04×135g=5.4g,所以SO2Cl2的产为$\frac{4.2g}{5.4g}$×100%=77.8%,
故答案为:蒸馏;77.8%.
点评 本题考查实验制备方案,涉及对反应原理、装置及操作的分析评价、对仪器的识别、物质的分离提纯等,注意对物质性质信息的应用,难度中等.

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
已知:AgNO3与Cu( N03)2受热易分解,分解温度如表所示.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
(2)如表为不同温度时AgNO3的溶解度
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
(3)气体甲可以与NaOH溶液反应,产物之一为NaN02.已知常温时Ka(HN02)=4.9x10-4,常温下将0.1mol•L-1 NaOH溶液与0.2mol•L-1HN02溶液等体积混合后,溶液中离子浓度由大到小的顺序为c(NO2-)>c(Na+)>c(H+)>c(OH-).
(4)另一种提纯AgN03溶液的方法为:向含有Cu2+的AgNO3溶液中加入某固体,充分反应后滤去蓝色沉淀即可,该固体可以为D(填选项字母).
A.NaOH B.AgCl C.FeS D.Ag2O
(5)制得的AgN03可配制为标准溶液,在中性或弱碱性溶液中,以K2Cr04为指示剂测定氯化物中Cl-的含量,主要反应为:
Ag++Cl-═AgCl↓ 2Ag++Cr042-(黄色)═Ag2Cr04↓砖红色)
已知Ksp(AgCl)=1.8×lO-10,Ksp(AgCrO4)=1.2×l0-12,则用该方法测定NaCl溶液中的c(Cl-)时,达到滴定终点时的现象为当滴入最后一滴AgNO3后有砖红色沉淀生成;实验中指示剂K2Cr04的浓度不宜过大,原因为K2CrO4溶液为黄色,浓度过大将影响滴定终点现象的判断(或K2CrO4溶液浓度过大时,有可能会在Cl-未完全沉淀时与Ag+结合,对滴定结果造成误差).
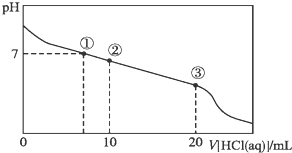
| A. | 点①所示溶液中,溶质为未反应完的CH3COONa、生成的CH3COOH和NaCl,微粒之间的关系为:c(CH3COOH)>c(Cl-)>c(OH-)=c(H+) | |
| B. | 点②所示溶液中,醋酸钠有一半与盐酸反应,微粒之间的关系为:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中,醋酸钠与盐酸恰好完全反应,微粒之间的关系为:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中有可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
| A. | 减压 | B. | 加压 | C. | 适当降温 | D. | 升高温度 |
| A. | 将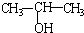 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 | |
| B. | 乙酰水杨酸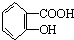 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 | |
| C. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| D. | 苯酚在溴化铁催化作用下与液溴反应生成溴苯 |
| A. | 溶剂质量不变 | B. | 溶质质量变大 | C. | 溶液的浓度不变 | D. | 溶解度增大 |
| 选项 | 古文或谚语 | 化学解释 |
| A | 日照香炉生紫烟 | 碘的升华 |
| B | 以曾青涂铁,铁赤色如铜 | 置换反应 |
| C | 煮豆燃豆萁 | 化学能转化为热能 |
| D | 雷雨肥庄稼 | 自然固氮 |
| A. | A | B. | B | C. | C | D. | D |