题目内容
4. 充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.
充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.已知:①甲品牌充电宝属于锂钒氧化物凝胶电池,其电池总反应为
V2O5+xLi$?_{充电}^{放电}$LixV2O5
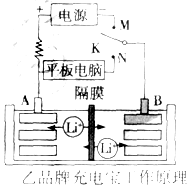
②乙品牌充电宝工作原理如图所示,该电池的总反应式为Li1-xMnO2+LixC6$?_{充电}^{放电}$LiMnO2+C6(LixC6表示锂原子嵌入石墨形成的复合材料):
请回答下列问题:
(1)甲品牌充电宝放电时,正极的电极反应式为V2O5+xe-+xLi+═LixV2O5
(2)图中K与N相接时,负极的电极反应式为LixC6-xe-═xLi++C6,Li+由B区迁移到A区(填写“A”或“B”)
(3)图中K与M相接时,阳极的电极反应式为LiMnO2-xe-═Li1-xMnO2+xLi+.
分析 (1)该反应中Li元素化合价由0价变为+1价,V元素化合价由+5价变为+$\frac{10-x}{2}$价,放电时,Li是负极,电极反应式为xLi-xe-═xLi+,正极反应式为V2O5+xe-+xLi+═LixV2O5;
(2)当K与N相接时,该装置是原电池,B为负极,A为正极,负极上发生氧化反应,正极上发生还原反应,原电池放电时,电解质溶液中阳离子向正极移动,阴离子向负极移动;
(3)当K与M相接时,该装置是电解池,A为阳极,阳极上失电子发生氧化反应,B为阴极,发生还原反应.
解答 解:(1)该反应中Li元素化合价由0价变为+1价,V元素化合价由+5价变为+$\frac{10-x}{2}$价,放电时,Li是负极,电极反应式为xLi-xe-═xLi+,正极反应式为V2O5+xe-+xLi+═LixV2O5,故答案为:V2O5+xe-+xLi+═LixV2O5;
(2)K与N相接时,B极为负极,该电极反应式为:LixC6-xeˉ=C6+xLi+,K与N相接时,A为正极,B为负极,Li+由B极区迁移到A极区,
故答案为:LixC6-xe-═xLi++C6; B;A;
(3)当K与M相接时,该装置是电解池,A为阳极,阳极上失电子发生氧化反应,电极反应式为:LiMnO2-xeˉ=Li1-xMnO2+xLi+,
故答案为:LiMnO2-xe-═Li1-xMnO2+xLi+.
点评 本题以新型电池为载体考查原电池和电解池原理,明确原电池和电解池电极上得失电子即可解答,注意原电池放电时,阴阳离子的移动方向,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答:
(1)将已称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除 500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒;
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞;
(3)用0.20mol•Lˉ1的标准盐酸滴定待测液,判断滴定终点的现象是:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色;
(4)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是BCDF;
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
F.滴定前尖嘴有气泡,滴定后消失
(5)根据下列数据计算,烧碱的纯度为91%(保留整数).
(1)将已称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除 500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒;
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞;
(3)用0.20mol•Lˉ1的标准盐酸滴定待测液,判断滴定终点的现象是:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色;
(4)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是BCDF;
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
F.滴定前尖嘴有气泡,滴定后消失
(5)根据下列数据计算,烧碱的纯度为91%(保留整数).
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.60 | 20.50 |
| 第二次 | 10.00 | 3.00 | 23.10 |
15.跟氨分子所含的质子总数和电子总数都相同的粒子是( )
| A. | Na+ | B. | Mg2+ | C. | HCl | D. | HF |