题目内容
 太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.(1)亚铜离子(Cu+)基态时的价电子排布式表示为
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为
(3)Cu晶体的堆积方式是
A.[Cu (NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Cu(NH3)4]2+中Cu2+给出孤对电子,NH3提供空轨道
C.[Cu (NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因.
①H3BO3中B的原子杂化类型为
②写出硼酸在水溶液中的电离方程式
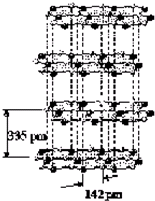
(5)硅与碳是同一主族元素,其中石墨为混合型晶体,已知石墨的层间距为335pm,C-C键长为142pm,计算石墨晶体密度(要求写出计算过程,得出结果保留三位有效数字,NA为6.02×1023mol-1)
考点:原子核外电子排布,配合物的成键情况,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)根据构造原理写出其核外电子排布式;
(2)同一周期中元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于其相邻元素;
(3)Cu晶体的堆积方式是面心立方最密堆积,配位数为12;根据的[Cu(NH3)4]SO4结构判断选项;
(4)硼酸(H3BO3)溶于水显弱酸性,但它却只是一元酸,说明硼酸分子中含有一个羟基,根据价层电子对互斥理论确定B原子的杂化类型;
(5)根据密度计算公式ρ=m/V计算.
(2)同一周期中元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于其相邻元素;
(3)Cu晶体的堆积方式是面心立方最密堆积,配位数为12;根据的[Cu(NH3)4]SO4结构判断选项;
(4)硼酸(H3BO3)溶于水显弱酸性,但它却只是一元酸,说明硼酸分子中含有一个羟基,根据价层电子对互斥理论确定B原子的杂化类型;
(5)根据密度计算公式ρ=m/V计算.
解答:
解:(1)铜是29号元素,铜原子失去一个电子变成亚铜离子,所以亚铜离子核外有28个电子,基态铜离子(Cu+)的价电子排布式为:3d10;
故答案为:3d10;
(2)As、Se、Br属于同一周期且原子序数逐渐增大,这三种元素依次属于第IVA族、第VA族、第VIA族,第VA族元素大于其相邻元素的第一电离能,所以3种元素的第一电离能从大到小顺序为Br>As>Se;
故答案为:Br>As>Se;
(3)Cu晶体的堆积方式是面心立方最密堆积,配位数为12;
A、N与H原子形成极性共价键,[Cu(NH3)4]2+与SO42-形成离子键,Cu2+与NH3形成配位键,故A正确;
B、氨气分子的键角小于水分子的键角,故B错误;
C、金属的第一电离能比非金属元素的第一电离能大,故C错误;
D、SO42-与PO43-原子个数相等,价电子数相等,互为等电子体,空间构型均为正四面体,故D正确;
故答案为:面心立方最密堆积;12;AD;
(4)①H3BO3中B的价层电子对=3+
(3+1-4×1)=3,所以采取sp2杂化,故答案为:sp2;
②硼酸为一元弱酸,H3BO3+H2O?[B(OH)4]-+H+,故答案为:H3BO3+H2O?[B(OH)4]-+H+;
(5)石墨的层间距为335pm,可以认为一层石墨的厚度是335pm.对某一层石墨中的一个六元环,正六边形环的边长是142pm,面积S=6×
×142×142sin(
π)=52387.6 pm2.环的厚度h=335pm那么一个环占有的体积V=Sh=52387.6×335=1.754×107pm3=1.754×10-23cm3.六元环中每个C原子都被3个环共用,一个环实际有2个C原子.一个环的质量m=
=2×12.01÷(6.02×1023)=3.99×10-23g.所以,石墨的密度ρ=
=
=2.27g?cm-3,答:石墨晶体密度为2.27g?cm-3.
故答案为:3d10;
(2)As、Se、Br属于同一周期且原子序数逐渐增大,这三种元素依次属于第IVA族、第VA族、第VIA族,第VA族元素大于其相邻元素的第一电离能,所以3种元素的第一电离能从大到小顺序为Br>As>Se;
故答案为:Br>As>Se;
(3)Cu晶体的堆积方式是面心立方最密堆积,配位数为12;
A、N与H原子形成极性共价键,[Cu(NH3)4]2+与SO42-形成离子键,Cu2+与NH3形成配位键,故A正确;
B、氨气分子的键角小于水分子的键角,故B错误;
C、金属的第一电离能比非金属元素的第一电离能大,故C错误;
D、SO42-与PO43-原子个数相等,价电子数相等,互为等电子体,空间构型均为正四面体,故D正确;
故答案为:面心立方最密堆积;12;AD;
(4)①H3BO3中B的价层电子对=3+
| 1 |
| 2 |
②硼酸为一元弱酸,H3BO3+H2O?[B(OH)4]-+H+,故答案为:H3BO3+H2O?[B(OH)4]-+H+;
(5)石墨的层间距为335pm,可以认为一层石墨的厚度是335pm.对某一层石墨中的一个六元环,正六边形环的边长是142pm,面积S=6×
| 1 |
| 2 |
| 1 |
| 3 |
| M |
| NA |
| m |
| V |
| 3.99 |
| 1.754 |
点评:本题考查了晶胞的计算、元素周期律、原子杂化等知识点,这些都是学习重点也是学习难点,同时考查学生的空间想象能力、分析问题能力、数学分析逻辑能力等,难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列实验现象的描述错误的是( )
| A、新制氯水使紫色石蕊试液变红 |
| B、向NaHCO3固体加入新制氯水,有无色气体产生 |
| C、向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,呈血红色 |
| D、在新制氯水中滴加AgNO3溶液有白色沉淀生成 |
普通干电池中装有二氧化锰和其他物质,二氧化锰的作用是( )
| A、和正极作用把碳变成CO2 |
| B、把正极附近生成的氢气氧化成水 |
| C、电池中发生化学反应的催化剂 |
| D、和负极作用,将锌变成锌离子Zn2+ |
化学在人类生活中扮演着重要角色,以下应用不正确的是( )
| A、用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 |
| B、浓硫酸具有吸水性,可用来干燥O2、Cl2、NH3等气体 |
| C、醋可用于除去暖水瓶中的水垢 |
| D、FeCl3可用来制印刷电路板 |
下列化学用语表达正确的是( )
A、乙酸的分子比例模型图为: |
B、Mg原子结构示意图: |
| C、次氯酸的结构式为:H-Cl-O |
| D、丙烯的结构简式:CH3CH2CH |
