题目内容
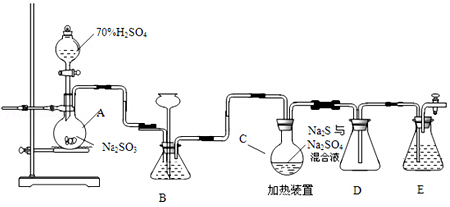
9.某校化学小组学生利用如图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中尾气处理装置均已略去)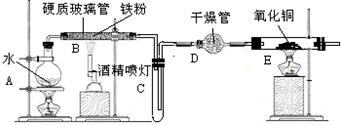
回答下列问题:
(1)圆底烧瓶中除加入水外还需加入的物质是碎瓷片.
(2)装置B中发生反应的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(3)装置E中的现象是固体由黑色变为红色,管壁有水珠.
(4)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.简述检验滤液中Fe3+的操作方法取少量滤液,滴入几滴KSCN溶液,观察溶液变血红色,则含有Fe3+.
(5)该小组学生利用在上述滤液中通入氯气的方式制取FeCl3•6H2O晶体,通入Cl2的作用是将滤液中含有的Fe2+氧化成Fe3+.
分析 由图可知,A提高水蒸气,B中发生3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,生成氢气具有可燃性,点燃时需要验纯,D中碱石灰干燥氢气,E中氢气还原CuO,结合铁离子遇KSCN溶液为血红色来解答.
(1)由图可知,A提高水蒸气,烧瓶底部放置了几片碎瓷片是防止加热液体暴沸;
(2)铁和水蒸气反应生成四氧化三铁和氢气;
(3)E中氢气还原CuO生成铜和水;
(4)依据铁离子和KSCN溶液反应生成血红色溶液设计实验验证;
(5)根据流程结合氯气的强氧化性分析氯气的作用.
解答 解:(1)由图可知,A提高水蒸气,加热液体防止暴沸,所以烧瓶底部还还需加入的物质是几片碎瓷片,故答案为:碎瓷片;
(2)B中发生铁和水蒸气反应生成四氧化三铁和氢气,方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)E中氢气还原CuO,观察到的现象为固体由黑色变为红色,管壁有水珠,故答案为:固体由黑色变为红色,管壁有水珠;
(4)检验滤液中Fe3+的操作方法为取少量滤液,滴入几滴KSCN溶液,观察溶液变血红色,则含有Fe3+,故答案为:取少量滤液,滴入几滴KSCN溶液,观察溶液变血红色,则含有Fe3+;
(5)因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,2Fe2++Cl2═2Fe3++2Cl-,
故答案为:将滤液中含有的Fe2+氧化成Fe3+.
点评 本题考查了铁及其化合物的性质实验,题目难度不大,注意掌握铁与水蒸气反应原理,试题侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.


| A. | c点对应的溶液中大量存在的离子可能为:Na+、H+、Cl-、NO3- | |
| B. | 将25℃时的KCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 | |
| C. | t℃<25℃ | |
| D. | ac线上的任意一点溶液均有c(H+)=c(OH-) |
| A. |  | B. |  | C. |  | D. |  |
(1)请帮助他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液
实验记录:
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为黄色 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+=Zn2++Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中加入足量铁粉 | 溶液由黄色变为浅绿色 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | 在FeCl3溶液中滴入适量KI溶液和淀粉溶液 | 变蓝色 | 2Fe3++2I-=2Fe2++I2 | Fe3+具有氧化性 |
(2)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时如何防止亚铁盐被氧化加铁粉.
(3)检验某铁盐溶液中是否含有亚铁盐的方法是取少量溶液于试管中滴加1滴酸性KMnO4溶液,若紫色褪去,则有Fe2+.
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)该反应达到平衡时,四氧化二氮的转化率为60%,表中c2>c3(填“>”、“<”或“=”).
(2)20s时四氧化二氮的浓度c1=0.070mol/L,在0s~20s时间段内,四氧化二氮的平均反应速率为0.0015mol/(L•s).
(3)100℃时,该反应的平衡常数K=0.36mol/L.
(4)若在相同情况下最初向该容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是0.200mol/L.
(5)若在相同情况下向该容器中充入0.2mol四氧化二氮和0.3mol二氧化氮气体,则到达平衡前v(正)> v(逆)(填“>”、“<”或“=”).
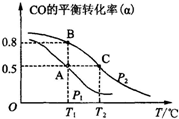 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.