题目内容
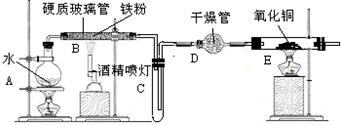
1.FeCl3在现代工业生产中应用广泛.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.工业上,向500-600℃的铁屑中通入氯气可生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁.某化学研究性学习小组模拟工业生产流程制备无水FeCl3并对产物做了如下探究实验,请回答下列问题:(1)装置的连接顺序为a、g、h、d、e、b、c、f(用a、b、c…h表示).
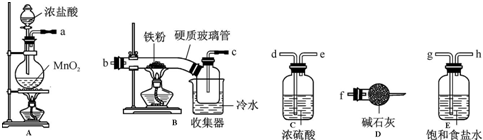
(2)i.A中装置气密性检验方法把导气管a的一端浸入盛水容器中,用酒精灯轻微加热.若导气管口有气泡冒出,停止加热,在导管内形成一段水柱,则不漏气.
ii.D中碱石灰的作用是吸收没有反应完的氯气,以防污染空气,同时吸收空气中的水蒸气,防止生成的FeCl3潮解.
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端.要使沉积得FeCl3进入收集器,需进行的操作是在沉积的FeCl3固体下方加热.
(4)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
固体混合物$\stackrel{过量稀盐酸}{→}$淡黄色溶液$\stackrel{试剂X}{→}$淡红色溶液$\stackrel{过量H_{2}O_{2}溶液}{→}$深红色色溶液$\stackrel{静置一段时间}{→}$红色褪去
(5)已知红色褪去的同时有气体生成,经检验为O2.该小组同学对红色褪去的原因进行探究.
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红
色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀.
②另取同物质的量浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化.
实验①说明SCN-发生了反应而不是Fe3+发生反应;
实验②的目的是排除H2O2分解产生的O2氧化SCN-的可能;
得出结论:H2O2将SCN-氧化成SO42-.
分析 生产无水氯化铁流程:A装置:制取氯气,实验室常用浓盐酸与二氧化锰加热制取MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,制得的氯气中含有HCl和水蒸气,所以先通过E饱和食盐水除HCl,再通C浓硫酸除水蒸气,再通到装置B发生铁和氯气反应2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,最后通入装置D用碱石灰吸收没有反应完的氯气,以防污染空气,同时吸收空气中的水蒸气,防止生成的FeCl3潮解,据此分析解答;
(1)根据排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理分析;
(2)i.根据检查装置的气密性的方法来解答该题;
ii.装置D用碱石灰吸收没有反应完的氯气,以防污染空气,同时吸收空气中的水蒸气,防止生成的FeCl3潮解;
(3)要使沉积的FeCl3进入收集器,根据FeCl3加热易升华的性质;
(5)根据①滴加FeCl3溶液无明显变化,说明SCN-发生了反应而不是Fe3+发生反应,滴加稀HCl和BaCl2溶液,产生白色沉淀,说明生成了硫酸根;
根据②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-.
解答 解:(1)浓硫酸具有吸水性能作氯气干燥剂、碱石灰具有碱性而吸收氯气、饱和食盐水吸收氯化氢而抑制氯气溶解,装置排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理,所以装置连接顺序为a→g→h→d→e→b→c→f,故答案为:a、g、h、d、e、b、c、f;
(2)i.根据检查装置的气密性的方法可以知道:把导气管a的一端浸入盛水容器中,用酒精灯轻微加热.若导气管口有气泡冒出,停止加热,在导管内形成一段水柱,则不漏气;故答案为:把导气管a的一端浸入盛水容器中,用酒精灯轻微加热.若导气管口有气泡冒出,停止加热,在导管内形成一段水柱,则不漏气;
ii.根据以上分析,装置D用碱石灰吸收没有反应完的氯气,以防污染空气,同时吸收空气中的水蒸气,防止生成的FeCl3潮解,故答案为:吸收没有反应完的氯气,以防污染空气,同时吸收空气中的水蒸气,防止生成的FeCl3潮解;
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端.要使沉积得FeCl3进入收集器,需进行的操作是对FeCl3加热发生升华使沉积的FeCl3进入收集器,
故答案为:在沉积的FeCl3固体下方加热;
(5)根据①滴加FeCl3溶液无明显变化,说明SCN-发生了反应而不是Fe3+发生反应,滴加稀HCl和BaCl2溶液,产生白色沉淀,说明生成了硫酸根,所以实验①说明SCN-发生了反应而不是Fe3+发生反应;
根据②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-,所以氧化SCN-的为双氧水,则实验②的目的是排除H2O2分解产生的O2氧化SCN-的可能;
故答案为:SCN-发生了反应而不是Fe3+发生反应;排除H2O2分解产生的O2氧化SCN-的可能;H2O2将SCN-氧化成SO42-.
点评 本题通过探究氯气与铁反应,考查了物质性质实验方案的设计方法,题目难度稍大,注意掌握氯气与铁反应的现象、反应原理,明确物质性质实验方案的设计原则,试题充分考查了学生的分析、理解能力及化学实验能力.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | a气体的相对分子质量一定比b气体的相对分子质量大 | |
| B. | a气体可能是CO,b气体可能是CH4 | |
| C. | A气球中所含气体分子数大于B气球中所含气体分子数 | |
| D. | 充气后,A气球的质量一定大于B气球的质量 |
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾 | 0.84 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
(2)在溶液配制过程中,卜^列操作对配制结果没有影响的是BD.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(3)一鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为0.0233mol/L.