题目内容
1. 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.(1)一定温度下,向固定体积为2L的密闭容器中充入SO2和NO2各1mol,发生反应SO2(g)+NO2(g)?SO3(g)+NO(g),测得上述反应5min末到达平衡,此时容器中NO与NO2的体积比为3:1,则这段时间内SO2的反应速率υ(SO2)=0.075mol/(L•min),此反应在该温度下的平衡常数K=9.
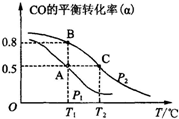
(2)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为放热反应(填“放热”或“吸热”).
②A、B、C三点的平衡常数KA、KB、KC的大小关系为KA=KB>KC.A、B两点对应的压强大小关系是PA小于PB(填“大于”、“小于”或“等于”).
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为O2+2H2O+4e-=4OH-,理论上通过外电路的电子最多为30mol.
分析 (1)设参加反应的SO2为nmol
SO2(g)+NO2(g)=SO3(g)+NO(g)
反应前(mol) 1 1 0 0
反应了(mol) n n n n
5min末(mol) 1-n 1-n n n
可以此计算相关量;
(2)①化学平衡图象分析方法,平衡图象题主要注意三点一趋势,三点是:图象的起点、拐点、终点,一趋势是看曲线的变化趋势.当然要看好横、纵坐标的向量.
②对于一个给定的化学反应,化学平衡常数的影响因素只有温度;
③碱性条件下,正极发生还原反应生成OH-.
解答 解(1)设参加反应的SO2为nmol
SO2(g)+NO2(g)=SO3(g)+NO(g)
反应前(mol) 1 1 0 0
反应了(mol) n n n n
5min末(mol) 1-n 1-n n n
$\frac{n}{1-n}$=$\frac{3}{1}$可求得:n=$\frac{3}{4}$=0.75
υ(SO2)=$\frac{0.75}{2×5}$=0.075mol/(L•min)
因其体积是2L,求出各自的浓度代入可求K
K=$\frac{0.375×0.375}{0.125×0.125}$=9
故答案为:0.075mol/(L•min);9;
(2)①从图上可见,在P2时,随温度的升高CO的转化率越来越低,可见,升温时平衡向逆向移动,据勒夏特列原理,正反应放热.
故答案为:放热;
②化学平衡常数只受温度的影响,该反应放热,温度越高平衡逆向移动,K值减小.增大压强,平衡正向移动,CO的转化率增大,可知PA 小于PB,
故答案为:KA=KB>KC;小于;
③燃料电池的正极,是氧气反应,在碱性条件下有水参与生成氢氧根.O2+2H2O+4e-=4OH-
A点CO的平衡转化率50%,参加反应的CO为:10mol×50%=5mol
从CO(g)+2H2(g)=CH3OH(g)分析,生成CH3OH也为5mol,CH3OH燃烧生成二氧化碳和水,只有C的价态从-2变为+4,H、O价态没变,所以1molCH3OH燃烧转移6mol电子,故5molCH3OH反应转移电子为:5×6=30.
故答案为:O2+2H2O+4e-=4 OH-;30.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握化学平衡的计算方法以及图象的判断,把握电极方程式的书写,难度不大.

| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 加入催化剂,有利于合成氨的反应 | |
| C. | 将混合气体中的氨液化,有利于合成氨的反应 | |
| D. | 工业生产硫酸的过程中,使用过量的空气以提高二氧化硫的转化率 |

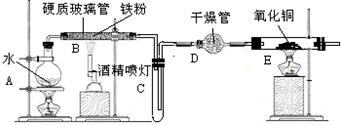
(1)用“可抽动的铁丝”代替“直接投入铁片”的优点是可随时控制反应的进行和停止.
(2)说明SO2气体产生的实验现象是品红褪色;装置C的作用是吸收多余的SO2气体,防止尾气污染(环境).
(3)反应一段时间后,他们对试管A中溶液的金属离子进行探究,请完成相关试题:
①提出假设:假设1:只含有Fe3+;
假设2:只含有Fe2+;
假设3:既有Fe2+,又有Fe3+.
②请设计实验方案验证假设3.
限选试剂:稀硫酸、KMnO4溶液、KSCN溶液、NaOH溶液、H2O2溶液.
| 实验步骤 | 预期现象 |
| 步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 | |
| 步骤二:检验Fe3+,往试管Ⅰ中,滴入几滴KSCN溶液 | 溶液呈现血红色 |
| 步骤三:检验Fe2+,往试管Ⅱ中,滴入少量KMnO4溶液(或先滴入几滴稀硫酸) | 紫红色变浅或消褪 |
A.脱水性 B.强氧化性 C.吸水性
若要验证反应产物中同时混有SO2气体和CO2气体,可选择以下试剂进行实验:
①NaOH溶液②品红溶液③溴水④Ca(OH)2溶液,选择合适试剂并安排合理的顺序为②③②④.
NaBr+H2SO4═HBr+NaHSO4 ①
R-OH+HBr?R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下;
| 物质 | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.
a.圆底烧瓶 b量筒. c.锥形瓶 d.容量瓶
(2)溴代烃的水溶性小于(填“大于”、“等于”或“小于”)相应的醇;其原因是醇分子可与水分子形成氢键,溴代烃分子不能与水分子形成氢键.
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,水层在上层(填“上层”、“下层”或“不分层”).
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的不正确的是a.
a.水是反应的催化剂 b.减少Br2的生成
c.减少HBr的挥发 d减少副产物烯和醚的生成
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其原因是平衡向生成溴乙烷的方向移动;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出.
| A. | 恒容容器内混合气体的密度不再变化 | |
| B. | AB3的生成速率与B2的生成速率之比为2:3 | |
| C. | 恒压容器内混合气体的总物质的量不再变化 | |
| D. | 单位时间内断裂a mol A≡A键,同时断裂6a mol A-B键 |




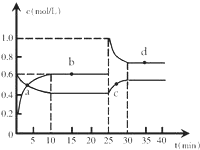 在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.