题目内容
7.铜锌原电池(如图)工作时,下列叙述正确的是( )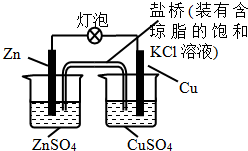
| A. | 一段时间后,铜棒上有红色物质析出 | |
| B. | 正极反应为:Zn-2e-=Zn2+ | |
| C. | 在外电路中,电流从锌棒流向铜棒 | |
| D. | 盐桥中的K+移向ZnSO4溶液 |
分析 由图可知,铜锌原电池中Zn为负极,失去电子,Cu为正极,正极上发生Cu2++2e-=Cu,电流从正极流向负极,阳离子向正极移动,以此来解答.
解答 解:A.一段时间后,正极上发生Cu2++2e-=Cu,则铜棒上有红色物质析出,故A正确;
B.Cu为正极,正极上发生Cu2++2e-=Cu,故B错误;
C.Cu为正极,Zn为负极,则在外电路中,电流从铜棒流向锌棒,故C错误;
D.阳离子向正极移动,则盐桥中的K+移向CuSO4溶液,故D错误;
故选A.
点评 本题考查原电池,为高频考点,把握原电池的正负极判断、电极反应及离子移动、电流方向等为解答的关键,侧重原电池工作原理的考查,题目难度不大.

练习册系列答案
相关题目
18. 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0
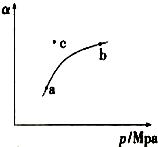
(1)某温度下,测得SO2(g)的平衡转化率(α)与体系总压强( p )的关系如上图所示.a、b两点对应的平衡常数K(a)= K(b) (填“>”“<”或“=”,下同)SO3浓度c(a)<c(b) c点,反应速率υ(正)<υ(逆).
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
①实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为$\frac{1.2}{t}$mol•L-1•min-1 ,②温度T1大于T2的理由是反应放热,温度升高,平衡向左移动,反应物转化率低.
 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0(1)某温度下,测得SO2(g)的平衡转化率(α)与体系总压强( p )的关系如上图所示.a、b两点对应的平衡常数K(a)= K(b) (填“>”“<”或“=”,下同)SO3浓度c(a)<c(b) c点,反应速率υ(正)<υ(逆).
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
12.将下表中各组的两电极用导线相连后放入盛有对应该组的溶液中,能产生电流的是( )
| 序号 | 电极1 | 电极2 | 溶液 |
| A | Cu | Cu | 稀H2SO4 |
| B | Ag | Zn | 稀H2SO4 |
| C | Cu | Cu | 酒精 |
| D | C | C | ZnSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
19.如图是某同学设计的原电池装置,下列叙述中不正确的是( )
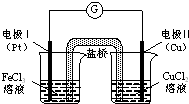

| A. | 电极Ⅰ上发生还原反应,作原电池的正极 | |
| B. | 电极Ⅱ的电极反应式为:Cu-2e-═Cu2+ | |
| C. | 该原电池的总反应为:2Fe3++Cu═Cu2++2Fe2+ | |
| D. | 盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
16.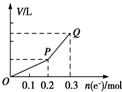 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A. | 0.1mol CuO | B. | 0.1 mol CuCO3 | ||
| C. | 0.1mol Cu(OH)2 | D. | 0.05 mol Cu2(OH)2CO3 |
14.在实验室可用图1所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.

图中:①为氯气发生装置;
②的试管里盛有15mL30%KOH 溶液.并置于热水浴中;
③的试管里盛有15mL 8% NaOH 溶液.并置于冰水浴中;
④的试管里加有紫色石蕊溶液; ⑤为尾气吸收装置.
请填写下列空白:
(l)写出钾离子的结构示意图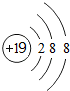 .
.
(2)制取氯气时,在烧瓶里加入一定量的二氧化锰,向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(选填下列字母)的净化装置.
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出,分离出该晶体的方法是过滤(填写实验操作名称).图2中符合该晶体溶解度曲线的是M(填写编号)
(4)本实验中制取次氯酸钠的离子方程式是:Cl2+2OH-=Cl-+ClO-+H2O
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:

图中:①为氯气发生装置;
②的试管里盛有15mL30%KOH 溶液.并置于热水浴中;
③的试管里盛有15mL 8% NaOH 溶液.并置于冰水浴中;
④的试管里加有紫色石蕊溶液; ⑤为尾气吸收装置.
请填写下列空白:
(l)写出钾离子的结构示意图
 .
.(2)制取氯气时,在烧瓶里加入一定量的二氧化锰,向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(选填下列字母)的净化装置.
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出,分离出该晶体的方法是过滤(填写实验操作名称).图2中符合该晶体溶解度曲线的是M(填写编号)
(4)本实验中制取次氯酸钠的离子方程式是:Cl2+2OH-=Cl-+ClO-+H2O
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |