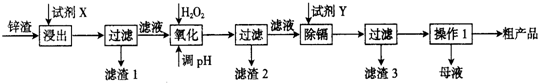
题目内容
8.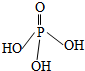 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )| A. | 三聚磷酸中P的化合价为+5 | |
| B. | 三聚磷酸钠的化学式为Na3P3O10 | |
| C. | 按上述原理,四聚磷酸的化学式为H6P4O13 | |
| D. | 多聚磷酸的结构可表示为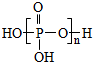 |
分析 磷酸分子间通过羟基脱水形成三聚磷酸,所以三聚磷酸的结构式为: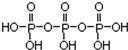 ,分子式为H5P3O10,P元素的化合价为+5价,三聚磷酸中羟基的氢原子被钠离子取代生成三聚磷酸钠(俗称“五钠”),三聚磷酸钠的化学式为:Na5P3O10,
,分子式为H5P3O10,P元素的化合价为+5价,三聚磷酸中羟基的氢原子被钠离子取代生成三聚磷酸钠(俗称“五钠”),三聚磷酸钠的化学式为:Na5P3O10, 发生缩聚反应可生成
发生缩聚反应可生成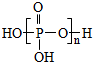 ,
,
以此解答该题.
解答 解:A.三聚磷酸分子式为H5P3O10,H元素化合价为+1价,O为-2价,则P元素的化合价为+5价,故A正确;
B.三聚磷酸中羟基的氢原子被钠离子取代生成三聚磷酸钠,三聚磷酸钠的化学式为:Na5P3O10,故B错误;
C.按上述原理,四聚磷酸即四个磷酸分子间脱去三个水分子形成的化合物,故化学式为H6P4O13,故C正确;
D.磷酸分子间通过羟基脱水形成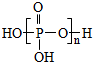 ,故D正确.
,故D正确.
故选B.
点评 本题考查物质的结构和性质,为高频常见题型和高频考点,侧重于学生的分析能力的考查,注意把握物质的结构特点和的性质,为解答该类题目的关键,难度不大.

练习册系列答案
相关题目
4.对于A2+3B2?2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=0.8mol(L•s)-1 | B. | v(A2)=0.4 mol(L•s)-1 | ||
| C. | v(C)=0.6 mol(L•s)-1 | D. | v(D)=0.1 mol(L•s)-1 |
16.查阅资料:无水醋酸钠是无色无味的结晶体,在空气中可被风化,可燃.用无水醋酸钠与碱石灰加热可以制得X气体,并进行相应的实验:
(1)装置E中反应方程式是CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+X↑,X的化学式是CH4.
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①C装置所盛放液体试剂是饱和食盐水;
②B装置的作用是除去Cl2中含有的HCl;光照后所得产物有5种;
③装置D的作用是连通大气,平衡压强;接收可能溢出的液体;
(3)某学生为了测定X的组成进行实验探究,选用了F、G、H仪器:
①该同学依次连接的合理顺序是E、G、H、F;
②该同学测定的相关数据是:
数据是否完全,说明原因数据是不完全,因为只能确定有机物中的碳氢元素含量,不能确定是否含有氧元素,应称取C 装置实验前后的质量;
由以上数据可知X中碳氢两种原子的物质的量之比>(选填“>”、“<”)1:4,造成这种结果的原因是F 装置后面与空气接触,空气中的水蒸气和CO2进入了F 装置,造成含碳量偏大.

(1)装置E中反应方程式是CH3COONa+NaOH$→_{△}^{CaO}$Na2CO3+X↑,X的化学式是CH4.
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①C装置所盛放液体试剂是饱和食盐水;
②B装置的作用是除去Cl2中含有的HCl;光照后所得产物有5种;
③装置D的作用是连通大气,平衡压强;接收可能溢出的液体;
(3)某学生为了测定X的组成进行实验探究,选用了F、G、H仪器:
①该同学依次连接的合理顺序是E、G、H、F;
②该同学测定的相关数据是:
| 装置 | 实验前的质量/g | 实验后的质量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
由以上数据可知X中碳氢两种原子的物质的量之比>(选填“>”、“<”)1:4,造成这种结果的原因是F 装置后面与空气接触,空气中的水蒸气和CO2进入了F 装置,造成含碳量偏大.
20.下列实验中,操作和现象均正确且能实验相应目的是( )
| 选项 | 实验目的 | 操作 | 现象 |
| A | 比较酸性:HF>H2CO3 | 向盛有少量NaHCO3溶液的试管中滴加足量HF溶液 | 有无色气体产生 |
| B | 验证SO2的漂白性 | 将SO2通入石蕊溶液中 | 石蕊溶液褪色 |
| C | 比较非金属性:Br>I | 将溴水滴加到KI-淀粉溶液中 | 溶液变蓝 |
| D | 检验某溶液中是否含有SO42- | 向盛有少量待测液的试管中先滴加Ba(NO3)2溶液,再滴加稀盐酸 | 有白色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
17.某有机化合物M的结构简式为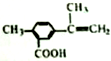 ,有关该化合物的叙述正确的是( )
,有关该化合物的叙述正确的是( )
 ,有关该化合物的叙述正确的是( )
,有关该化合物的叙述正确的是( )| A. | 该有机物属于芳香烃 | |
| B. | 仅考虑取代基在苯环上的位置变化,M的同分异构体有9种 | |
| C. | 该有机物的碳原子一定处于同一平面 | |
| D. | 该有机物一定条件下只能发生加成反应和酯化反应 |
18.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
(1)写出实验中发生反应的离子方程式:Zn+2H+=Zn2++H2↑,
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g 锌薄片溶解于酸中需花12.5 s.
(3)对比结果B与F,解释结果F那么快的原因:B中锌是块状,F中锌是粉末状,粉末状时锌与酸溶液的接触面要 比块状时的接触面大得多.
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g 锌薄片溶解于酸中需花12.5 s.
(3)对比结果B与F,解释结果F那么快的原因:B中锌是块状,F中锌是粉末状,粉末状时锌与酸溶液的接触面要 比块状时的接触面大得多.
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.