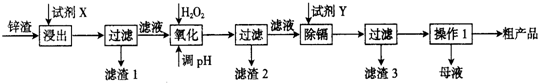
题目内容
19.非金属性最强的元素在元素周期表的( )| A. | 左下方 | B. | 右上方 | C. | 右下方 | D. | 左上方 |
分析 同一周期元素,元素非金属性随着原子序数增大而增强,同一主族元素,元素非金属性随着原子序数增大而减弱,据此分析解答.
解答 解:同一周期元素,元素非金属性随着原子序数增大而增强,同一主族元素,元素非金属性随着原子序数增大而减弱,所以周期表中非金属性最强的元素位于周期表右上方、金属性最强的元素位于周期表左下方,故选B.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素性质递变规律是解本题关键,熟悉元素周期表结构,题目难度不大.

练习册系列答案
相关题目
14.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:回答下列问题:
(1)写出下列元素的名称:C钠,E氯;
(2)写出A、B、C形成的化合物M的电子式 ;
;
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;在同主族元素氢化物的递变性质中,B的氢化物沸点反常,这可以用氢键来解释.
(4)写出两个由这五种元素中的两种形成的18电子体的结构式:H-Cl;H-O-O-H.
(5)D单质与M的水溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)写出A、B、C形成的化合物M的电子式
 ;
;(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;在同主族元素氢化物的递变性质中,B的氢化物沸点反常,这可以用氢键来解释.
(4)写出两个由这五种元素中的两种形成的18电子体的结构式:H-Cl;H-O-O-H.
(5)D单质与M的水溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
4.对于A2+3B2?2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=0.8mol(L•s)-1 | B. | v(A2)=0.4 mol(L•s)-1 | ||
| C. | v(C)=0.6 mol(L•s)-1 | D. | v(D)=0.1 mol(L•s)-1 |
11.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=-246.4 kJ•mol-1;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭恒容容器中加入CH3OH,反应到某时刻测得各组分浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04 mol•L-1;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
③下列措施中能说明反应达到平衡状态的是D
A.体系压强保持不变 B.混合气体的密度保持不变
C.CH3OH与H2O的浓度之比为1:2
D.单位时间内,消耗2mol CH3OH的同时消耗1molH2O.
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=-246.4 kJ•mol-1;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭恒容容器中加入CH3OH,反应到某时刻测得各组分浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04 mol•L-1;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
③下列措施中能说明反应达到平衡状态的是D
A.体系压强保持不变 B.混合气体的密度保持不变
C.CH3OH与H2O的浓度之比为1:2
D.单位时间内,消耗2mol CH3OH的同时消耗1molH2O.
2.实验探究:催化剂对化学反应速率影响根据所给出的仪器、实验方案回答表格中的问题:
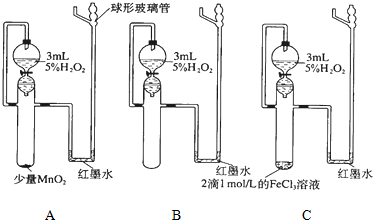

| 实验目的 | 催化剂对过氧化氢分解化学反应速率影响 | ||
| 实验步骤 | 在三个相同的带活塞的漏斗中分别加入2~3mL约5%的H2O2,然后在一支试管中滴加2滴1mol/L的FeCl3溶液,另一支试管中加入少量MnO2固体.同时向三支试管中放入漏斗中的全部溶液,观察红墨水上升情况. | ||
| 反应条件 | A少量MnO2 | B无催化剂 | C 2滴FeCl3溶液 |
| 实验现象 | |||
| 反应速 率大小 | (用v (A)、v (B)、v (C)表示) | ||
| 得出结论 | |||
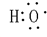 ;C22-(电子式)
;C22-(电子式) ;1,3-丁二烯(实验式)C2H3.
;1,3-丁二烯(实验式)C2H3.