题目内容
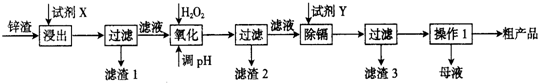
18.实验室以废铜为原料制取碱式碳酸铜 Cu2(OH)2CO3的过程如下:
完成下列填空:
(1)酸浸中产生的气体是NO、NO2(填化学式)
(2)检验过滤Ⅱ的沉淀是否洗净的方法是取最后一次洗涤液滴加氯化钡溶液,若溶液中没有出现沉淀,则沉淀已洗净.
(3)从实验流程中可看出影响产品生成的因素有多种,请写出其中两个:温度和pH,并任选其中一个因素,说明其原因温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率太慢,或:pH过低,得不到碱式碳酸铜,pH过高则生成氢氧化铜.
(4)CuSO4溶液和纯碱溶液混合同样也可以制得Cu2(OH)2CO3,写出该反应的化学方程式:2CuSO4+2Na2CO3+H2O→Cu2(OH)2CO3↓+2Na2SO4+CO2↑.
(5)产品中Cu含量的测定步骤是:称取mg样品,用适量稀硫酸完全溶解,加水稀释,调节溶液为中性或弱酸性,再加入过量的KI-淀粉溶液后,用c mol/L的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液v mL.实验中反应的离子方程式为:
2Cu2++4I-→2CuI(白色)↓+I2;
I2+2S2O32-→2I-+S4O62-
①样品溶于稀硫酸后,需加水稀释,控制溶液为中性或弱酸性,其原因是若溶液酸性过强,则2H++S2O32-→S↓+SO2+H2O,多消耗Na2SO3溶液.
②产品中Cu的含量为0.064cv/m(用含m、c、v的代数式表示).
分析 (1)酸浸中铜与浓硝酸反应生成二氧化氮,随着浓度的降低,会产生一氧化氮;
(2)根据流程分析可知,碱式碳酸铜是从含有碳酸钠的溶液中析出的,所以检验沉淀是否洗净就是检验沉淀上有没碳酸根离子;
(3)从实验流程中可看出温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率太慢,pH过低,得不到碱式碳酸铜,pH过高则生成氢氧化铜,据此答题;
(4)CuSO4溶液和纯碱溶液混合同样也可以制得Cu2(OH)2CO3,根据元素守恒可书写出反应的化学方程式;
(5)①样品溶于稀硫酸后,需加水稀释,控制溶液为中性或弱酸性,若溶液酸性过强,则2H++S2O32-→S↓+SO2+H2O,多消耗Na2S2O3溶液;
②根据 反应2Cu2++4I-→2CuI(白色)↓+I2; I2+2S2O32-→2I-+S4O62-可得关系式Cu2+~S2O32-,根据Na2S2O3的物质的量可求得样品中铜元素的质量,进而确定产品中Cu的含量;
解答 解:(1)酸浸中铜与浓硝酸反应生成二氧化氮(NO2),随着浓度的降低,会产生一氧化氮(NO),
故答案为:NO、NO2;
(2)根据流程分析可知,碱式碳酸铜是从含有碳酸钠的溶液中析出的,所以检验沉淀是否洗净就是检验沉淀上有没碳酸根离子,操作方法是取最后一次洗涤液滴加氯化钡溶液,若溶液中没有出现沉淀,则沉淀已洗净,
故答案为:取最后一次洗涤液滴加氯化钡溶液,若溶液中没有出现沉淀,则沉淀已洗净;
(3)从实验流程中可看出温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率太慢,pH过低,得不到碱式碳酸铜,pH过高则生成氢氧化铜,所以影响产品生成的因素有温度和pH,
故答案为:温度和pH;温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率太慢,或:pH过低,得不到碱式碳酸铜,pH过高则生成氢氧化铜;
(4)CuSO4溶液和纯碱溶液混合同样也可以制得Cu2(OH)2CO3,根据元素守恒可知反应的化学方程式为2CuSO4+2Na2CO3+H2O→Cu2(OH)2CO3↓+2Na2SO4+CO2↑,
故答案为:2CuSO4+2Na2CO3+H2O→Cu2(OH)2CO3↓+2Na2SO4+CO2↑;
(5)①样品溶于稀硫酸后,需加水稀释,控制溶液为中性或弱酸性,若溶液酸性过强,则2H++S2O32-→S↓+SO2+H2O,多消耗Na2S2O3溶液,
故答案为:若溶液酸性过强,则2H++S2O32-→S↓+SO2+H2O,多消耗Na2SO3溶液;
②根据 反应2Cu2++4I-→2CuI(白色)↓+I2; I2+2S2O32-→2I-+S4O62-可得关系式Cu2+~S2O32-,根据题意可知,Na2S2O3的物质的量为cv×10-3mol,所以样品中铜元素的质量为0.064cvg,进而确定产品中Cu的含量为0.064cv/m,
故答案为:0.064cv/m.
点评 本题考查了铜及其化合物性质的应用,制备实验方案的设计和分析判断,实验仪器的使用,离子检验方法的应用,化学方程式计算应用,难度中等,对学生综合能力有一定的要求.

 名校课堂系列答案
名校课堂系列答案| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)写出A、B、C形成的化合物M的电子式
 ;
;(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;在同主族元素氢化物的递变性质中,B的氢化物沸点反常,这可以用氢键来解释.
(4)写出两个由这五种元素中的两种形成的18电子体的结构式:H-Cl;H-O-O-H.
(5)D单质与M的水溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
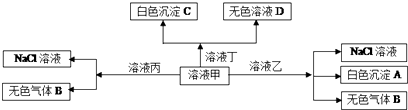
| A. | 甲为AlCl3,乙为NaHCO3 | |
| B. | 在甲中滴加丁开始反应的离子方程式:2HCO3-+Ba2++2OH-B═aCO3↓+2H2O+CO32- | |
| C. | 白色沉淀A不能溶解在溶液丁中 | |
| D. | 在丙中可以大量共存的有:Fe2+、SO42-、NO3- |
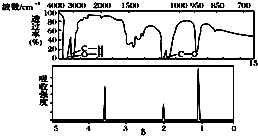
| A. | 由核磁共振氢谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由红外光谱可知,该有机物分子中有三种不同的氢原子 | |
| C. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 | |
| D. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
(1)将PM2.5样本用蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH${\;}_{4}^{+}$ | SO${\;}_{4}^{2-}$ | NO3 | Cl- |
| 浓度/mol•L-l | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)NOx是汽车尾气的主要污染物之一.
①汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:

则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1;
②用碱液吸收氮的氧化物是目前研究的课题,将NO、NO2通入石灰乳中可制备重要的工业原料Ca(NO2)2.该工艺需控制NO和NO2物质的量之比接近1:1.若n(NO2):n(NO)>1:1,则会导致产品Ca(NO2)2中Ca(NO3)2含量升高;若n(NO2):n(NO)<1:1,则会导致排放气体中NO含量升高.
(3)燃煤烟气中的CO、SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫.反应体系中各组分的物质的量与反应时间的关系如图2所示,写出该反应的化学方程式4CO+2SO2=4CO2+S2.
(4)科学家用氮化镓材料与铜组装如图3所示的人工光合系统.利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.
(5)天然气也可重整生产化工原料.最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图4,则X的结构简式为
 .
. | A. | C17H19NO3 | B. | C17H21NO4 | C. | C17H25NO3 | D. | C25H27NO7 |
| A. | (A-x+n) mol | B. | (A-x-n) mol | C. | (A-x+n)$\frac{w}{A}$ mol | D. | (A-x-n)$\frac{w}{A}$ mol |
①增加反应物的物质的量
②升高温度
③缩小容器的体积
④加入生成物.
| A. | ①②④ | B. | ②④ | C. | ①②③ | D. | 只有② |