题目内容
8.下列各组顺序的排列不正确的是( )| A. | 原子半径:Na>Mg>Al | B. | 碱性强弱:NaOH>Mg(OH)2>Ca(OH)2 | ||
| C. | 热稳定性:HCl>PH3>AsH3 | D. | 酸性强弱:H4SiO4<H3PO4<HNO3 |
分析 A.同周期从左向右原子半径减小;
B.金属性越强,对应碱的碱性越强;
C.非金属性越强,对应氢化物的稳定性越稳定;
D.同周期从左向右非金属性增强,非金属性越强,对应最高价含氧酸的酸性越强.
解答 解:A.同周期从左向右原子半径减小,则原子半径为Na>Mg>Al,故A正确;
B.由金属活动性顺序可知金属性Ca>Na>Mg,则碱性为Ca(OH)2>NaOH>Mg(OH)2,故B错误;
C.同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则热稳定性:HCl>PH3>AsH3,故C正确,
D.同周期从左向右非金属性增强,非金属性越强,对应最高价含氧酸的酸性越强,则酸性强弱:H4SiO4<H3PO4<HNO3,故D正确;
故选B.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
16.元素单质及其化合物有广泛用途,对于元素周期表中第3周期的元素来说,按原子序数递增的顺序(稀有气体除外),以下说法正确的是( )
| A. | 原子半径和离子半径均减小 | |
| B. | 金属性减弱,非金属性增强 | |
| C. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| D. | 单质的熔点降低 |
20.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1L 0.1mol•L碳酸钠溶液中,阴离子数目小于0.1NA | |
| B. | 0.lmol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA | |
| C. | 常温常压下,6g乙酸所含共价键数目为0.7NA | |
| D. | 1mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
17.下列有关化学用语表示正确的是( )
| A. | 四氯化碳分子的电子式为: | |
| B. | C1-的结构示意图: | |
| C. | 醋酸的电离方程式:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 聚丙烯的结构简式: |
 ,新戊烷的结构简式为C(CH3)4.
,新戊烷的结构简式为C(CH3)4.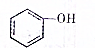 (填“>”、“<”或“=”,下同)
(填“>”、“<”或“=”,下同)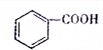 (提示:类比醇与酚的酸性)
(提示:类比醇与酚的酸性) .
. .
.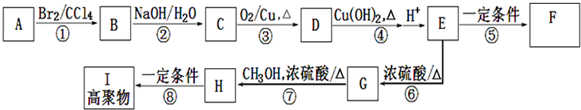
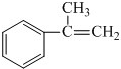 ;E在一定条件下能形成3个六元环的物质,该物质的结构简式为:
;E在一定条件下能形成3个六元环的物质,该物质的结构简式为: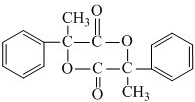 .
.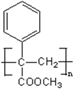 .
.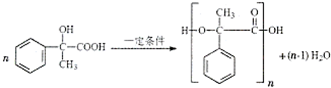 .
.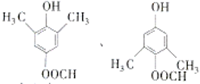 .
.

 .
.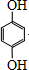 .
.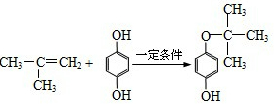 ,反应类型是加成反应.
,反应类型是加成反应.