题目内容
20.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 1L 0.1mol•L碳酸钠溶液中,阴离子数目小于0.1NA | |
| B. | 0.lmol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA | |
| C. | 常温常压下,6g乙酸所含共价键数目为0.7NA | |
| D. | 1mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
分析 A.1L0.1mol•L-1碳酸钠溶液中,还含有OH-,阴离子总数大于0.1NA;
B.铁和水蒸气反应时,3mol铁生成4mol氢气;
C,求出乙酸的物质的量,然后根据1mol乙酸中含8mol共价键来分析;
D.1mol苯和1mol苯甲酸燃烧时均消耗7.5mol氧气.
解答 解:A.1L0.1mol•L-1碳酸钠溶液中,还含有OH-,阴离子总数大于0.1NA,故A错误;
B.铁和水蒸气反应时,3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,3mol铁生成4mol氢气,故0.1mol铁生成$\frac{4}{30}$mol氢气,故B错误;
C.6g乙酸的物质的量为0.1mol,而1mol乙酸中含8mol共价键,故0.1mol乙酸中含0.8NA个共价键,故C错误;
D.1mol苯和1mol苯甲酸燃烧时均消耗7.5mol氧气,故1mol苯和苯甲酸的混合物燃烧消耗7.5mol氧气,即7.5NA个氧气分子,与两者的比例无关,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是组成有机物的基本骨架元素,元素Y的核电荷数等于W原子的最外层电子数,元素Z的最高正化合价为+2价.下列说法正确的是( )
| A. | X的氢化物沸点大于Y的氢化物沸点 | |
| B. | Z在Y中燃烧生成的化合物中既含有离子键,又含有共价键 | |
| C. | 原子半径由大到小的顺序:X、Y、Z | |
| D. | 最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X |
11.pH值相等的盐酸(甲)和醋酸(乙),分别与一定量的锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是( )
| A. | 反应开始时的速率:甲<乙 | |
| B. | 反应开始时,酸的物质的量浓度:甲>乙 | |
| C. | 反应开始时,酸的物质的量浓度:甲<乙 | |
| D. | 反应所需时间:甲<乙 |
8.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na>Mg>Al | B. | 碱性强弱:NaOH>Mg(OH)2>Ca(OH)2 | ||
| C. | 热稳定性:HCl>PH3>AsH3 | D. | 酸性强弱:H4SiO4<H3PO4<HNO3 |
5.实验室制备Al(OH)3最好选用的试剂是( )
| A. | Al2O3和稀盐酸 | B. | Al2O3和水 | C. | Al2(SO4)3和NaOH | D. | AlCl3和氨水 |
9.4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2为工业制硫酸的重要要反应,下列说法正确的是( )
| A. | 02是还原剂 | B. | FeS2是氧化剂 | ||
| C. | 02失去电子 | D. | FeS2发生氧化反应 |
10.下列叙述中正确的是( )
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 当各轨道处于全满.半满.全空时原子较稳定 | |
| D. | 同一周期中,碱金属元素的第一电离能最大 |
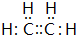 B的结构简式
B的结构简式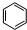 .
. ,反应类型:取代反应.
,反应类型:取代反应.