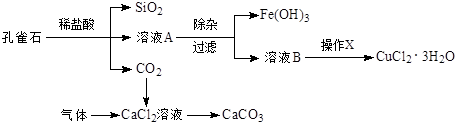
题目内容
有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:
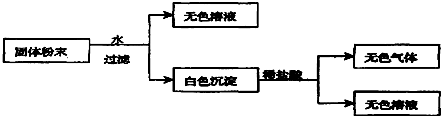
从实验可以判断,该固体粉末中
(1)一定不含有 ,
(2)它的组成可能是 或 .
(3)加入盐酸后发生反应的离子方程式为 .
(4)要进一步确定其组成还应进行的实验操作是 .

从实验可以判断,该固体粉末中
(1)一定不含有
(2)它的组成可能是
(3)加入盐酸后发生反应的离子方程式为
(4)要进一步确定其组成还应进行的实验操作是
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:固体粉CaCO3、Na2SO4、BaCl2、CuSO4溶于水有沉淀、无色溶液,则能排除CuSO4,因为CuSO4溶于水显蓝色;难溶物溶于稀盐酸,说明一定含有碳酸钙,硫酸钠和氯化钡不会同时存在,还有一种物质就是硝酸钾,以此解答该题.
解答:
解:固体粉CaCO3、Na2SO4、BaCl2、CuSO4溶于水有沉淀、无色溶液,则能排除CuSO4,因为CuSO4溶于水显蓝色;难溶物溶于稀盐酸,说明一定含有碳酸钙,硫酸钠和氯化钡不会同时存在,还有一种物质就是硝酸钾,
(1)因为CuSO4溶于水显蓝色,而溶液无色,则一定不存在CuSO4,故答案为:CuSO4;
(2)由以上分析可知,一定含有CaCO3,硫酸钠和氯化钡不会同时存在,则组成可能为CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2;
故答案为:CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2;
(3)加入盐酸,碳酸钙和盐酸反应生成二氧化碳气体,离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(4)不能确定的物质的为Na2SO4、BaCl2,可向滤液中滴加硫酸,若产生白色沉淀说明混合物中含有BaCl2,否则含有Na2SO4,
故答案为:向滤液中滴加硫酸,若产生白色沉淀说明混合物中含有BaCl2,否则含有Na2SO4.
(1)因为CuSO4溶于水显蓝色,而溶液无色,则一定不存在CuSO4,故答案为:CuSO4;
(2)由以上分析可知,一定含有CaCO3,硫酸钠和氯化钡不会同时存在,则组成可能为CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2;
故答案为:CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2;
(3)加入盐酸,碳酸钙和盐酸反应生成二氧化碳气体,离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(4)不能确定的物质的为Na2SO4、BaCl2,可向滤液中滴加硫酸,若产生白色沉淀说明混合物中含有BaCl2,否则含有Na2SO4,
故答案为:向滤液中滴加硫酸,若产生白色沉淀说明混合物中含有BaCl2,否则含有Na2SO4.
点评:本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及反应现象,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关叙述正确的是( )
| A、配制一定物质的量浓度的溶液和萃取实验前,都必须检验所用仪器是否漏水 |
| B、将4 g NaOH溶入准确量取的100 mL水中,可制得浓度为1 mol/L的NaOH溶液 |
| C、如果不慎将稀盐酸沾到皮肤上,应先用NaOH溶液涂抹,再用水冲洗 |
| D、最好用蒸馏的方法分离出CCl4和水的混合物 |
25℃时,下列关于电解质及其溶液的说法,正确的是( )
| A、BaSO4在饱和Na2SO4溶液中的溶解度与Ksp均比在纯水中的小 |
| B、若将0.01molNaOH溶于1L水,则溶液中由水电离产生的c(H+)=1×10-12mol?L-1 |
| C、10ml0.5mol?L-1CH3COONa溶液与6ml1mol?L-1盐酸混合:c(Cl-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| D、pH=4的HA与pH=10的BOH溶液等体积混合,所得溶液pH=7,则HA、BOH一定为强酸和强碱 |
下列关于杂化轨道的叙述中,不正确的是( )
| A、分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构 |
| B、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子 |
| C、N2分子中N原子没有杂化,分子中有1个σ键、2个π键 |
| D、H2SO4分子中三种原子均以杂化轨道成键 |