题目内容
下列叙述或操作不正确的是( )
| A、向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、稀释浓硫酸时应将水沿着烧杯壁慢慢地注入盛有浓硫酸的烧杯中,并不断搅拌 |
| D、浓硫酸能与铜反应,说明浓硫酸有强氧化性 |
考点:浓硫酸的性质,硝酸的化学性质
专题:
分析:A.浓硫酸能将蔗糖中的H、O元素以2:1形式脱去;
B.浓硝酸不稳定,在光照条件下分解生成二氧化氮,二氧化氮溶于硝酸而使溶液呈黄色;
C.稀释浓硫酸时将浓硫酸倒入水中;
D.加热条件下,浓硫酸和Cu反应生成硫酸铜而体现强氧化性.
B.浓硝酸不稳定,在光照条件下分解生成二氧化氮,二氧化氮溶于硝酸而使溶液呈黄色;
C.稀释浓硫酸时将浓硫酸倒入水中;
D.加热条件下,浓硫酸和Cu反应生成硫酸铜而体现强氧化性.
解答:
解:A.浓硫酸能将蔗糖中的H、O元素以2:1形式脱去,而体现脱水性,故A正确;
B.浓硝酸不稳定,在光照条件下分解生成二氧化氮,反应方程式为4HNO3=4NO2↑+O2↑+2H2O,二氧化氮溶于硝酸而使溶液呈黄色,故B正确;
C.稀释浓硫酸时将浓硫酸倒入水中,并不断搅拌,防止局部温度过高而溅出液体,故C错误;
D.加热条件下,浓硫酸和Cu反应生成硫酸铜而体现强氧化性,反应方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故D正确;
故选C.
B.浓硝酸不稳定,在光照条件下分解生成二氧化氮,反应方程式为4HNO3=4NO2↑+O2↑+2H2O,二氧化氮溶于硝酸而使溶液呈黄色,故B正确;
C.稀释浓硫酸时将浓硫酸倒入水中,并不断搅拌,防止局部温度过高而溅出液体,故C错误;
D.加热条件下,浓硫酸和Cu反应生成硫酸铜而体现强氧化性,反应方程式为Cu+2H2SO4(浓)
| ||
故选C.
点评:本题考查浓硫酸、浓硝酸的性质,浓硫酸具有吸水性、脱水性和强氧化性,注意吸水性、脱水性的区别,知道浓硝酸、浓盐酸溶液呈黄色的原因,题目难度不大.

练习册系列答案
相关题目
下列各组物质相互混合反应后,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到FeCl3溶液中
②过量Ba(OH)2浓溶液和NH4Al(SO4)2溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④Na2O2投入FeCl2溶液中.
①金属钠投入到FeCl3溶液中
②过量Ba(OH)2浓溶液和NH4Al(SO4)2溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④Na2O2投入FeCl2溶液中.
| A、只有①④ | B、只有③ |
| C、只有②③ | D、只有①②④ |
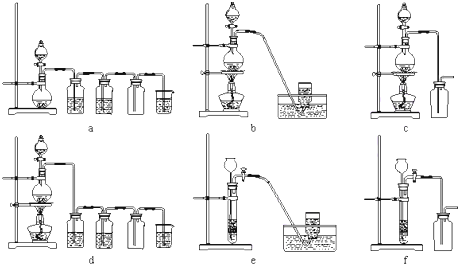
下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的气体(暂不考虑尾气吸收).关于这些装置的接,下列说法正确的是( )
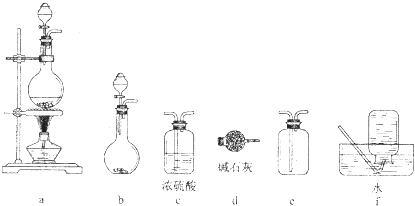

| A、制备收集C2H4:连接a→d→f |
| B、制备收集NO2:连接a→c→f |
| C、制备收集Cl2:连接a→d→e |
| D、制备收集NH3:连接b→→e |
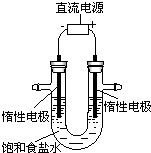 电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是
电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是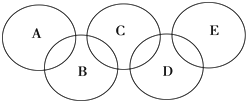 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素, ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2,根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2,根据以上信息回答下列问题: