题目内容
11.下列离子方程式正确的是( )| A. | 氢氧化钠溶液中通入足量二氧化硫:SO2+2OH-═SO32-+2H2O | |
| B. | 石灰石与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 向少量碳酸氢钠溶液中滴加足量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
分析 A.反应生成亚硫酸氢钠;
B.醋酸在离子反应中保留化学式;
C.电子、电荷不守恒;
D.反应生成碳酸钙、NaOH和水.
解答 解:A.氢氧化钠溶液中通入足量二氧化硫的离子反应为SO2+OH-═HSO3-,故A错误;
B.石灰石与醋酸反应的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++H2O+CO2↑,故B错误;
C.钠与水反应的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故C错误;
D.向少量碳酸氢钠溶液中滴加足量澄清石灰水的离子反应为Ca2++OH-+HCO3-=CaCO3↓+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
2.绿色能源是指使用过程中不排放或排放极少污染物的能源.下列属于绿色能源的是( )
①太阳能 ②风能 ③石油 ④煤 ⑤潮汐能 ⑥木材 ⑦地热能.
①太阳能 ②风能 ③石油 ④煤 ⑤潮汐能 ⑥木材 ⑦地热能.
| A. | ①②③⑤ | B. | ②④⑤⑥ | C. | ③④⑤⑦ | D. | ①②⑤⑦ |
19.下列说法不正确的是( )
| A. | 氢能、太阳能、核能均为新能源 | |
| B. | 生物质能的利用主要有直接燃烧、生物化学转换和热化学转换等方式 | |
| C. | 通过煤的气化、液化等物理方法将煤转化为CO、CH4等燃料气体,可以提高煤燃烧的热效率 | |
| D. | 地球上最基本的能源是太阳能,大自然利用太阳能最成功的是植物的光合作用 |
6.某同学对无水乙醇与金属钠的反应进行实验探究.请回答:
(1)仪器a的名称是干燥管.
(2)请写出无水乙醇与钠反应的化学方程式:2CH3CH2OH+2Na=2CH3CH2ONa+H2.
(3)下列有关该实验的说法中,正确的是CD.
A.无水乙醇与钠的反应是吸热反应
B.酸性重铬酸钾溶液的作用是除去乙醇蒸气中混有的氢气
C.仪器a的球形区域对产生的气体起到一定的富集作用,使得气体燃烧的火焰明亮,现象明显
D.操作步骤②中的现象有:加入无水乙醇后,钠表面有气泡,钠开始时沉在液体的底部,然后浮在液面上,直至消失.
| 实验装置 | 操作步骤 | 实验现象 |
 | ①用橡胶管将尖嘴管和仪器a连接,向仪器a的球形区域塞入一团脱脂棉,再向脱脂棉中滴入适量的酸性K2Cr2O7溶液 | 棉花呈橙黄色 |
| ②取黄豆大小的金属钠,用滤纸吸干其表面的煤油,放入小烧杯中,用仪器a的柱体部分扣住金属钠,再向小烧杯中倒入10mL左右无水乙醇,至高度没过金属钠 | ||
| ③反应开始20s左右,点燃尖嘴管处的气体,并在尖嘴管上方罩上内壁涂有澄清石灰水的小烧杯 | 产生明亮的淡蓝色火焰,仪器a内的脱脂棉逐渐由橙黄色变为绿色(Cr3+颜色),烧杯内壁未变浑浊 | |
| ④实验结束后测量反应液的温度 | 反应液的温度为52℃ |
(2)请写出无水乙醇与钠反应的化学方程式:2CH3CH2OH+2Na=2CH3CH2ONa+H2.
(3)下列有关该实验的说法中,正确的是CD.
A.无水乙醇与钠的反应是吸热反应
B.酸性重铬酸钾溶液的作用是除去乙醇蒸气中混有的氢气
C.仪器a的球形区域对产生的气体起到一定的富集作用,使得气体燃烧的火焰明亮,现象明显
D.操作步骤②中的现象有:加入无水乙醇后,钠表面有气泡,钠开始时沉在液体的底部,然后浮在液面上,直至消失.
16.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 3.2gO2和O3的混合物中含有的氧原子数目为0.2NA | |
| B. | 1L0.1mol/L的醋酸溶液中含有氢离子数目为0.1NA | |
| C. | 标准状况下,2.24LCCl4含碳原子数目为0.1NA | |
| D. | 将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 mL水中含有的分子数目约为1.24NA | |
| B. | 1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 | |
| C. | 23g钠在氧气中完全燃烧失去电子数为0.5NA | |
| D. | 常温常压下的33.6L氯气与56g铁充分反应,转移电子数为3NA |
20.下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )
| A. | CuCl2 | B. | FeCl2 | C. | FeCl3 | D. | NaCl |
9.下列实验设计、操作或实验现象不合理的是( )
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| C. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸后,再做银镜反应实验或与新制Cu(OH)2共热的实验 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀硝酸,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
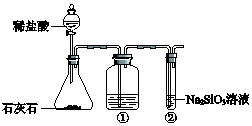 C、Si是构成无机非金属材料的重要元素.
C、Si是构成无机非金属材料的重要元素.