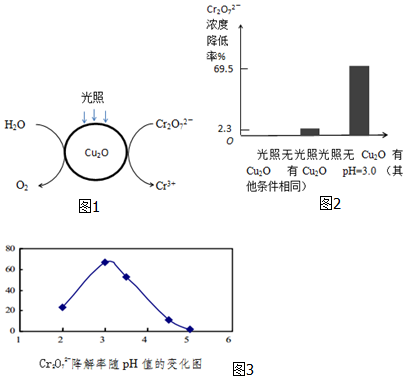
题目内容
1. C、Si是构成无机非金属材料的重要元素.
C、Si是构成无机非金属材料的重要元素.(1)Si在周期表中的位置为第三周期 IVA族.
(2)为比较C、Si的非金属性,某同学设计了如下实验:
装置①中盛放的试剂是饱和NaHCO3溶液,装置②中发生反应的离子方程式是CO2+H2O+SiO32-=H2SiO3↓+CO32-.
(3)SiC是一种重要的高温耐磨材料.SiC中,C元素显负(填“正”或“负”)化合价,从原子结构角度解释原因是C、Si均位于 IVA族,从上到下原子半径逐渐增大,原子核对最外层电子吸引能力逐渐减弱,元素非金属减弱.
分析 (1)Si是14号元素,三个电子层,最外层4个电子,在周期表中的位置为第三周期 IVA族;
(2)发生装置中进入①的气体中混有氯化氢气体,所以要将溶液通入饱和的碳酸钠溶液;反应的离子方程式为:CO2+H2O+SiO32-=H2SiO3↓+CO32-;
(3)碳的非金属性强于硅,所以SiC中,C元素显负价,同主族从上往下非金属性减弱,原子核对最外层电子吸引能力逐渐减弱,由此分析解答.
解答 解:(1)Si是14号元素,三个电子层,最外层4个电子,在周期表中的位置为第三周期 IVA族,故答案为:第三周期 IVA族;
(2)发生装置中进入①的气体中混有氯化氢气体,所以要将溶液通入饱和的碳酸钠溶液;反应的离子方程式为:CO2+H2O+SiO32-=H2SiO3↓+CO32-,故答案为:饱和NaHCO3溶液;CO2+H2O+SiO32-=H2SiO3↓+CO32-;
(3)碳的非金属性强于硅,所以SiC中,C元素显负价,同主族从上往下非金属性减弱,原子核对最外层电子吸引能力逐渐减弱,故答案为:负;C、Si均位于 IVA族,从上到下原子半径逐渐增大,原子核对最外层电子吸引能力逐渐减弱,元素非金属减弱.
点评 本题将元素及其化合物、元素周期律与非金属性强弱比较的实验设计结合起来,具有较强的综合性,有一定的难度,注意实验设计的原理和方法.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
11.某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,已知稀HNO3有强氧化性,下列说法不正确的是( )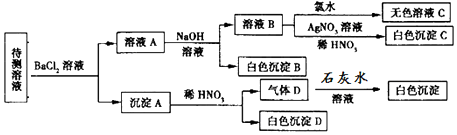

| A. | SO42-、SO32-至少含有一种 | |
| B. | 沉淀B的化学式为BaCO3 | |
| C. | 肯定存在的阴离子有CO32-、HCO3-、Cl- | |
| D. | 肯定没有的离子是Br- |
16.下列有关SO2的说法中,不正确的是( )
| A. | 溶于水能导电,属于电解质 | |
| B. | 使品红溶液褪色,有漂白性 | |
| C. | 使酸性高锰酸钾溶液褪色,有还原性 | |
| D. | 能杀菌、消毒,可按照国家标准用作食物的防腐剂 |
6.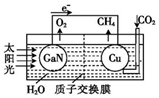 科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )
 科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | GaN表面发生氧化反应:2H2O-4 e-═O2↑+4H+ | |
| C. | Cu表面的反应是:CO2+8e-+6H2O═CH4+8OH? | |
| D. | H+透过质子交换膜从左向右迁移 |
10.我国第一部法医学专著《洗冤集录》中有一“银针验毒”的记载,“银针验毒”的原理是 4Ag+2H2S+O2=2X+2H2O,下列说法正确的是( )
| A. | 反应中Ag和H2S均是还原剂,发生氧化反应 | |
| B. | 银针验毒时,空气中的氧气失去电子 | |
| C. | X的化学式为Ag2S,颜色为黑色,通过观察银针颜色变化来判断死者是否中毒 | |
| D. | 每生成1mo1X,反应转移4mo1 e- |
11.下列离子方程式正确的是( )
| A. | 氢氧化钠溶液中通入足量二氧化硫:SO2+2OH-═SO32-+2H2O | |
| B. | 石灰石与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 向少量碳酸氢钠溶液中滴加足量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |