题目内容
20.下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )| A. | CuCl2 | B. | FeCl2 | C. | FeCl3 | D. | NaCl |
分析 排在H前面的金属与盐酸反应,氯气具有强氧化性,与变价金属反应生成高价金属氯化物,以此来解答.
解答 解:A.Cu与盐酸不反应,故A不选;
B.Fe与氯气反应生成氯化铁,故B不选;
C.Fe与盐酸反应生成氯化亚铁,故C不选;
D.Na与盐酸反应生成氯化钠,Na与氯气反应生成NaCl,故D选;
故选D.
点评 本题考查金属及化合物的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.我国第一部法医学专著《洗冤集录》中有一“银针验毒”的记载,“银针验毒”的原理是 4Ag+2H2S+O2=2X+2H2O,下列说法正确的是( )
| A. | 反应中Ag和H2S均是还原剂,发生氧化反应 | |
| B. | 银针验毒时,空气中的氧气失去电子 | |
| C. | X的化学式为Ag2S,颜色为黑色,通过观察银针颜色变化来判断死者是否中毒 | |
| D. | 每生成1mo1X,反应转移4mo1 e- |
11.下列离子方程式正确的是( )
| A. | 氢氧化钠溶液中通入足量二氧化硫:SO2+2OH-═SO32-+2H2O | |
| B. | 石灰石与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 向少量碳酸氢钠溶液中滴加足量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
8.下列反应中,SiO2作为氧化剂的是( )
| A. | SiO2+CaO=CaSiO3 | |
| B. | SiO2+2NaOH=Na2SiO3+H2O | |
| C. | SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO | |
| D. | SiO2+2Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑ |
15.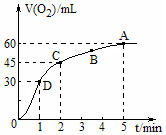 在50mL过氧化氢溶液中加入1g MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示,下列说法不正确的是( )
在50mL过氧化氢溶液中加入1g MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示,下列说法不正确的是( )
 在50mL过氧化氢溶液中加入1g MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示,下列说法不正确的是( )
在50mL过氧化氢溶液中加入1g MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示,下列说法不正确的是( )| A. | 标准状况下,实验放出一半气体所需的时间为1min | |
| B. | A、B、C、D各点反应速率中A点最慢,D点快 | |
| C. | 0~2min内产生O2的平均反应速率为22.5mL•min-1 | |
| D. | 本实验中影响反应速率的因素只有催化剂和H2O2的浓度 |
5.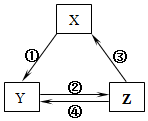 表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )
表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )
 表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )
表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
| B | Na | Na2O2 | NaCl | ②加H2O |
| C | NO | NO2 | HNO3 | ③与C加热 |
| D | Al2O3 | NaAlO2 | Al(OH)3 | ④与NaOH |
| A. | A | B. | B | C. | C | D. | D |
17.常温下,VL pH=2的盐酸与0.2L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是( )
| A. | V一定等于0.2 | |
| B. | V大于或等于0.2 | |
| C. | 混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 混合溶液中离子浓度一定满足:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |