题目内容
16.下列化学用语正确的是( )| A. | 乙烯的结构简式为:CH2CH2 | B. | 溴乙烷的分子式为:C2H5Br | ||
| C. | 丙烷分子的比例模型为: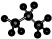 | D. | 四氯化碳分子的电子式为: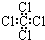 |
分析 A.乙烯分子中含有官能团碳碳双键,结构简式中需要标出官能团结构;
B.分子式表示分子中含有原子种类及数目;
C. 为球棍模型,比例模型主要体现出各原子的相对体积大小;
为球棍模型,比例模型主要体现出各原子的相对体积大小;
D.氯原子未成键的孤对电子对未画出.
解答 解:A.乙烯分子中含有2个碳原子和4个氢原子,两个碳原子之间通过共用2对电子形成一个碳碳双键,碳碳键与碳氢键之间夹角120度,为平面型结构,其结构简式为:CH2=CH2,故A错误;
B.溴乙烷可以看作溴原子取代了乙烷中1个H原子形成的,其分子式为:C2H5Br,故B正确;
C. 为丙烷的球棍模型,丙烷正确的比例模型为:
为丙烷的球棍模型,丙烷正确的比例模型为: ,故C错误;
,故C错误;
D.四氯化碳分子中,C、Cl原子最外层都满足8电子稳定结构,四氯化碳正确的电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、分子式、比例模型与球棍模型、结构简式等知识,明确常见化学用语的概念及书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
7.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为16.Y的原子半径比X的大,X与W同主族,Z 是地壳中含量最高的金属元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | Y、W最高价氧化物对应水化物均能溶解Z的氢氧化物 | |
| C. | 元素W的简单气态氢化物的热稳定性比X的强 | |
| D. | 元素X、Y只能形成一种化合物 |
4. 如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
(1)p为正极,A极发生了氧化(填反应类型)反应.
(2)D为阴极,试管里收集到H2.
(3)C极的电极方程式是4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测得C、D两极上产生的气体的实验数据如下:
仔细分析上表,请说出得到以上实验数据可能的原因是开始时阴、阳两极气体体积比为3:1,10分钟时约为2:1,说明开始时氧气溶解于溶液中.
(5)当电路中通过0.004mol电子时,B电极上沉积金属X的质量为0.128g,则此金属的摩尔质量为64g•mol-1.
(6)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”、“减小”或“不变”).
 如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:(1)p为正极,A极发生了氧化(填反应类型)反应.
(2)D为阴极,试管里收集到H2.
(3)C极的电极方程式是4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测得C、D两极上产生的气体的实验数据如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成 气体体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成 气体体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
(5)当电路中通过0.004mol电子时,B电极上沉积金属X的质量为0.128g,则此金属的摩尔质量为64g•mol-1.
(6)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”、“减小”或“不变”).
1.在该有机物的结构中没有的官能团( )


| A. | 羟基 | B. | 醚键 | C. | 碳碳双键 | D. | 酯基 |
8.与3.2gSO2所含的氧原子数相等的NO2的质量为( )
| A. | 2.3g | B. | 3.2g | C. | 4.6g | D. | 6.4g |
5.a、b、c、d、e为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c,e2-与a的离子具有相同的电子层结构.下列叙述错误的是( )
| A. | d元素最高价氧化物对应的水化物酸性比c最高价氧化物对应的水化物酸性强 | |
| B. | e与氢气化合比b与氢气化合更容易 | |
| C. | a元素的氢化物是离子化合物 | |
| D. | c在空气中点燃可生成其最高价氧化物 |
6.乙酸乙酯在KOH溶液中水解,得到的产物是( )
| A. | 乙酸钾 | B. | 甲醇 | C. | 乙醛 | D. | 乙酸 |
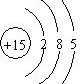 .
. .X在纯氧中燃烧的产物无毒无污染,该反应的化学方程式为4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
.X在纯氧中燃烧的产物无毒无污染,该反应的化学方程式为4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O. .
.