题目内容
4. 如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:(1)p为正极,A极发生了氧化(填反应类型)反应.
(2)D为阴极,试管里收集到H2.
(3)C极的电极方程式是4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测得C、D两极上产生的气体的实验数据如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成 气体体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成 气体体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
(5)当电路中通过0.004mol电子时,B电极上沉积金属X的质量为0.128g,则此金属的摩尔质量为64g•mol-1.
(6)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”、“减小”或“不变”).
分析 (1)接通电源,金属X沉积于B极,同时C、D产生气泡,则B为阴极,X离子在阴极放电生成金属单质,则A、C是阳极,B、D是阴极,连接阳极的是电源正极;
(2)电解硫酸溶液时,阴极上氢离子放电产生氢气;
(3)C电极是电解池阳极,阳极上氢氧根离子放电;
(4)根据氢气和氧气的溶解性和溶解度等方面进行分析;
(5)根据金属和转移电子之间的关系式计算;
(6)根据溶液中的氢离子和氢氧根离子浓度是否变化确定.
解答 解:(1)接通电源,金属X沉积于B极,同时C、D产生气泡,则B为阴极,X离子在阴极放电生成金属单质,则A、C是阳极,B、D是阴极,所以p是正极,A电极上失电子发生氧化反应,
故答案为:正;氧化;
(2)由(1)知,C是阳极,D是阴极,阴极上氢离子放电产生氢气,
故答案为:阴;H2;
(3)C是阳极,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O,
故答案为:4OH--4e-=O2↑+2H2O;
(4)氢气和氧气都难溶于水,但是氧气更易溶于水;所以1~6分钟内氧气比氢气溶解的快而多,从而导致阴、阳两极生成的气体体积之比大于2:1,
故答案为:开始时阴、阳两极气体体积比为3:1,10分钟时约为2:1,说明开始时氧气溶解于溶液中;
(5)设其摩尔质量为M,电解时,B电极上的电极反应式为:X2++2e-=X
2e-~~~X
2 1
0.004mol $\frac{0.128g}{M}$
M=$\frac{0.128g×2}{0.004mol}$=64g•mol-1,
故答案为:64g•mol-1;
(6)该电解池中,阳极上电极材料放电生成金属阳离子进入溶液,阴极上金属阳离子放电生成金属析出,进入的金属阳离子和析出的金属阳离子相等,所以溶液中的氢离子和氢氧根离子浓度都不变,则溶液的pH不变,
故答案为:不变.
点评 本题考查电解原理,明确惰性电极电解时离子的放电顺序及发生的电极反应是解答本题的关键,题目难度不大.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案| A. | H2S+2HNO3═S↓+2NO2↑十2H2O | B. | CuO+2HNO3═Cu (NO3)2十H2O | ||
| C. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑十O2↑十2H2O | D. | 3Cu+8HNO3═3Cu (NO3) 2+2NO↑十4H2O |
| A. | CH3Cl | B. | CCl4 | C. | CH2Cl2 | D. | HCl |
| A. | 1.7g羟基所含电子数目为NA | |
| B. | 1L 1mol/L的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 28 g聚乙烯含有的碳原子数为2nNA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA |
| A. | 含有极性键的化合物分子内一定不含有非极性键 | |
| B. | 分子内两种非金属元素的原子之间形成的化学键是极性键 | |
| C. | 离子化合物中一定含有金属阳离子和离子键 | |
| D. | 两种元素构成的共价化合物分子中的化学键一定都是极性键 |
| A. | 乙烯的结构简式为:CH2CH2 | B. | 溴乙烷的分子式为:C2H5Br | ||
| C. | 丙烷分子的比例模型为: | D. | 四氯化碳分子的电子式为: |
| A. | C2H2 | B. | CH3COOH | C. | SiC | D. | HCHO |
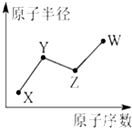 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随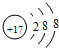 ;
;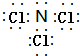 ;
;