题目内容
11.A、B、C、D、E为前四周期原子序数依次增大的五种元素.A原子半径是周期表中原子半径最小的;B可以和A形成两种常见的液态化合物甲和乙,且原子个数之比分别是1:1和1:2;C、D为同周期元索,C是所属周期的主族元素中电负性最小的;D的单质晶体是分子晶体,原子最外层有两个未成对电子;E位于周期表的ds区,E元素原子最外层有一个未成对电子.回答下列问题:(1)E2+的简化电子排布式是[Ar]3d9;甲和乙,沸点较高的是H2O2(填化学式);
(2)D与B形成常见的具有还原性的阴离子立体构型是三角锥形;则D显最高正价时与B形成的常见化合物的中心原子的杂化类型是sp2
(3)同时由ABCD四种元素组成的两种盐M和W,写出这两种盐溶液反应的离子方程式H+﹢HSO3-=H2O﹢SO2↑
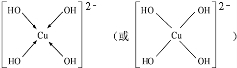
(4)由BDE三种元素组成常见盐溶液丙,向丙溶液加入过量NaOH溶液可生成[E(OH)4]2-,不考虑空间构型,[E(OH)4]2-的结构可用示意图表示为
(5)根据周期表对角线规则,铍和铝的性质有相似性,则书写铍单质和C的最高正价氧化物对应水化物溶液发生反应的离子方程式是Be+2OH-=BeO22-+H2↑.
分析 A、B、C、D、E为前四周期原子序数依次增大的五种元素;A原子半径是周期表中原子半径最小的,则A是H元素;B可以和A形成两种常见的液态化合物甲和乙,且原子个数之比分别是1:1和1:2,B是O元素,甲是H2O2、乙是H2O;E位于周期表的ds区,E元素原子最外层有一个未成对电子,则E是Cu元素;
C、D为同周期元索,C是所属周期的主族元素中电负性最小的,且C元素原子序数大于B,则C是Na元素;D的单质晶体是分子晶体,原子最外层有两个未成对电子,为S元素;
(1)E是Cu元素,其原子失去2个电子生成Cu2+,根据价层电子对互斥理论书写铜离子核外电子排布式;双氧水和水中都含有氢键,二者都是分子晶体,相对分子质量越大其熔沸点越高;
(2)D与B形成常见的具有还原性的阴离子立体构型是三角锥形,为SO32-;则D显最高正价时与B形成的常见化合物为SO3,SO3分子中S原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断中心原子的杂化类型;
(3)同时由ABCD四种元素组成的两种盐M和W,这两种盐一种是亚硫酸氢钠、一种是硫酸氢钠,二者反应生成二氧化硫和水;
(4)由O、S、Cu三种元素组成常见盐溶液丙,向丙溶液加入过量NaOH溶液可生成[E(OH)4]2-,不考虑空间构型,该配离子中Cu原子含有空轨道、O原子含有孤电子对,所以Cu和O原子之间存在配位键;
(5)Be和C的最高价氧化物的水化物NaOH溶液反应生成偏铍酸钠和氢气.
解答 解:A、B、C、D、E为前四周期原子序数依次增大的五种元素;A原子半径是周期表中原子半径最小的,则A是H元素;B可以和A形成两种常见的液态化合物甲和乙,且原子个数之比分别是1:1和1:2,B是O元素,甲是H2O2、乙是H2O;E位于周期表的ds区,E元素原子最外层有一个未成对电子,则E是Cu元素;
C、D为同周期元索,C是所属周期的主族元素中电负性最小的,且C元素原子序数大于B,则C是Na元素;D的单质晶体是分子晶体,原子最外层有两个未成对电子,为S元素;
(1)E是Cu元素,其原子失去2个电子生成Cu2+,根据价层电子对互斥理论书写铜离子核外电子排布式为[Ar]3d9;双氧水和水中都含有氢键,二者都是分子晶体,相对分子质量越大其熔沸点越高,所以熔沸点较高的是H2O2,
故答案为:[Ar]3d9;H2O2;
(2)D与B形成常见的具有还原性的阴离子立体构型是三角锥形,为SO32-;则D显最高正价时与B形成的常见化合物为SO3,SO3分子中S原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断中心原子的杂化类型为sp2,故答案为:sp2;
(3)同时由ABCD四种元素组成的两种盐M和W,这两种盐一种是亚硫酸氢钠、一种是硫酸氢钠,二者反应生成二氧化硫和水,离子方程式为H+﹢HSO3-=H2O﹢SO2↑,故答案为:H+﹢HSO3-=H2O﹢SO2↑;
(4)由O、S、Cu三种元素组成常见盐溶液丙,向丙溶液加入过量NaOH溶液可生成[E(OH)4]2-,不考虑空间构型,该配离子中Cu原子含有空轨道、O原子含有孤电子对,所以Cu和O原子之间存在配位键,其图为 ,
,
故答案为: ;
;
(5)Be和C的最高价氧化物的水化物NaOH溶液反应生成偏铍酸钠和氢气,离子方程式为Be+2OH-=BeO22-+H2↑,故答案为:Be+2OH-=BeO22-+H2↑.
点评 本题考查位置结构性质的相互关系和应用,为高频考点,涉及配位键、离子方程式的书写、原子杂化方式、原子核外电子排布等知识点,明确化学键、离子方程式的书写方法、价层电子对互斥理论等知识点是解本题关键,注意配位键的表示方法,为易错点.

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案| 实 验 序 号 | 时间(min) 浓度(mol•L-1) 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A. | 该反应是吸热反应,升温正、逆反应速率增大 | |
| B. | 实验3中 c3=1.2 mol•L-1 | |
| C. | 实验1与实验3比较,A的平衡转化率之比为1:2 | |
| D. | 实验2使用了催化剂,在0至10 min内平均速率υ(B)=0.02 mol•L-1•min-1 |
 1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示.老人为什么画这个结构式?它是 生命的前物质?它能合成吗?它有什么性质?不得而知.也许这是永远无法解开的谜;也许你有朝一日能解开它.某同学对此结构及性质有如下的推测,你认为不正确的是( )
1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示.老人为什么画这个结构式?它是 生命的前物质?它能合成吗?它有什么性质?不得而知.也许这是永远无法解开的谜;也许你有朝一日能解开它.某同学对此结构及性质有如下的推测,你认为不正确的是( )| A. | 它的分子式是C6N10H2O2 | |
| B. | 该物质最多可以有18个原子处于同一个平面上 | |
| C. | 它可以与别的物质发生加成反应 | |
| D. | 因其含氮量高,有可能作炸药 |

| A. | 用水润湿的pH试纸测量某溶液的pH | |
| B. | 用量筒量取20 mL 0.5000 mol•L-1 H2SO4溶液于烧杯中,加水80 mL,配制成0.1000 mol•L-1 H2SO4溶液 | |
| C. | 实验室用图①所示装置制取少量氨气 | |
| D. | 实验室用图②所示装置除去Cl2中的少量HCl |
| W | X | ||
| Y | Z |
(2)r(Yn+)<r(Xm-).(填“>”“﹦”“<”)
(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则A生成B的化学方程式为2Na+2NaOH+2H2O=2NaAlO2+3H2↑;B与C混合反应的离子方程式为Al3++3 AlO2-+6H2O=4Al(OH)3↓.
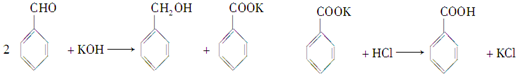
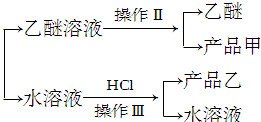
 实验室制备苯甲醇和苯甲酸的化学原理是
实验室制备苯甲醇和苯甲酸的化学原理是