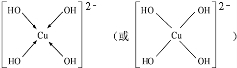
题目内容
2.1块表面已经氧化为氧化钠(Na2O)的金属钠的质量为10.8g,把它投入100g水中,在常温下放出氢气0.2g,求:(1)金属钠的纯度为多少?
(2)被氧化的金属钠的质量为多少?
(3)生成氢氧化钠的质量.
(4)所得溶液中溶质的质量分数.
分析 设10.8g反应物中含金属钠的质量为x,生成氢氧化钠的质量为y,
2Na+2H2O=2NaOH+H2↑
23×2 40×2 2
x y 0.2g
则:x=$\frac{23×2×0.2g}{2}$=4.6g,y=$\frac{40×2×0.2g}{2}=8g$,
(1)金属钠的质量为4.6g,用钠的质量比上产物总质量可计算出纯度;
(2)根据钠的质量计算出氧化钠的质量,然后利用质量守恒定律计算出被氧化的钠的质量;
(3)根据钠和氧化钠的质量,利用质量守恒可计算出氢氧化钠的质量;
(4)利用质量守恒定律计算出溶液质量,反应后溶质为氢氧化钠,然后计算出所得溶液的质量分数.
解答 解:设10.8g反应物中含金属钠的质量为x,生成氢氧化钠的质量为y,
2Na+2H2O=2NaOH+H2↑
23×2 40×2 2
x y 0.2g
则:x=$\frac{23×2×0.2g}{2}$=4.6g,y=$\frac{40×2×0.2g}{2}=8g$,
(1)金属钠的纯度为:$\frac{4.6g}{10.8g}×100%$=42.59%,
答:金属钠的纯度为42.59%;
(2)反应物中含氧化钠:m(Na2O)=10.8g-4.6g=6.2g,
设氧化钠中钠元素(即被氧化的钠)的质量为z,则62:46=6.2g:z,解得:z=4.6g,
答:被氧化的金属钠的质量为4.6g;
(3)设氧化钠溶于水生成的氢氧化钠的质量为b,
Na2O+H2O=2NaOH
62 2×40
6.2g b
则:$\frac{62}{6.2g}=\frac{2×40}{b}$,解得:b=8g,
生成氢氧化钠的质量为:m(NaOH)=8g+8g=16g,
答:生成的氢氧化钠的质量为16g;
(4)计算溶质的质量分数,必须求出反应后溶液的总质量,根据质量守恒关系,
m(溶液)=m(H2O)+m(Na)+m(Na2O)-m(H2)=100g+10.8g-0.2g=110.6g,
溶质的质量分数为:$\frac{16g}{110.6g}$×100%=14.47%,
答:溶质的质量分数为14.47%.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.

| A. | K+、Fe2+、SO32-、MnO4- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | Al3+、S2-、Cl-、SO42- | D. | Na+、AlO2-、Br-、Cl- |
| A. | 标准状况下,11.2升的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数为4NA | |
| C. | 标准状况下,11.2升二氯甲烷所含分子数为0.5NA | |
| D. | 现有C2H4、C3H6、C4H8的混合气体共14g,其原子数为3NA |
| A. | 出售给工厂作工业原料 | |
| B. | 就地焚烧成草木灰作植物的钾肥 | |
| C. | 应用化学科学的有关原理和方法制成甲烷作燃料 | |
| D. | 应用化学科学的有关原理和方法制成优质的牲畜饲料 |
| A. | 用渗析的方法精制氢氧化铁胶体 | |
| B. | SiO2、NaCl、I2、C2H6O均能真实表示物质分子组成 | |
| C. | “钴酞菁”分子(直径为1.3×10-9米)在水中形成的分散系能产生丁达尔效应 | |
| D. | 冰醋酸、铝热剂、硫酸钡、SO2分别属于酸、混合物、强电解质、非电解质 |
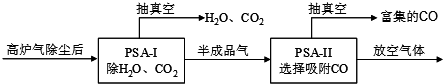
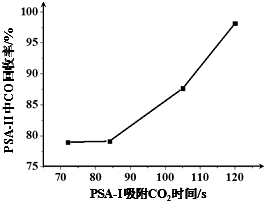
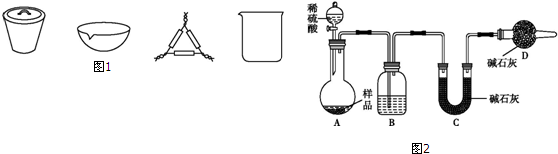
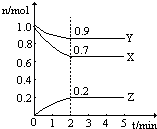 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: