题目内容
1.某化学反应2A(g)?B(g)+D(g)在四种不同条件下进行,B、D起始浓度均为0.反应物A的浓度(c/mol•L-1)随反应时间(t/min)的变化情况如下表:| 实 验 序 号 | 时间(min) 浓度(mol•L-1) 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A. | 该反应是吸热反应,升温正、逆反应速率增大 | |
| B. | 实验3中 c3=1.2 mol•L-1 | |
| C. | 实验1与实验3比较,A的平衡转化率之比为1:2 | |
| D. | 实验2使用了催化剂,在0至10 min内平均速率υ(B)=0.02 mol•L-1•min-1 |
分析 A、加热平衡向吸热反应方向移动;
B、以10至20min为例求出反应速率进行比较;
C、实验1与实验3是等效平衡,所以A的平衡转化率相等;
D、根据实验1、2数据分析.
解答 解:A、比较实验4和实验1可知平衡时实验4反应物A的浓度小,由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动,而且升高温度正逆反应速率都加快,故A正确;
B、在实验1中,反应在10至20min时间内平均速率为V=$\frac{△c}{△t}$=$\frac{0.80mol/L-0.67mol/L}{10min}$=0.013mol•(L•min)-1,在实验3中,反应在10至20min时间内平均速率为V=$\frac{△c}{△t}$=$\frac{0.92mol/L-0.75mol/L}{10min}$=0.015mol•(L•min)-1,故v3>v1,实验1的其实浓度为1.0mol/L,由平衡时浓度可知在实验3的起始浓度大于1.0mol/L,实验1和实验3是等效平衡,起始A的浓度为1.0mol/L时平衡浓度为0.5mol/L,而A的平衡浓度为0.6mol/L时,初起c3=1.2 mol•L-1,故B正确;
、实验1与实验3是等效平衡,所以A的平衡转化率相等,则平衡转化率之比为1:1,故C错误;
D、根据实验1、2数据分析,温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0mol•L-1 ;温度相同,达平衡后A的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂,而v(A)=$\frac{0.4}{10}$=0.04mol/(L.min),所以υ(B)=0.02 mol•L-1•min-1,故D正确;
故选C.
点评 本题考查化学平衡的计算与影响因素、反应速率计算、平衡常数应用等,侧重考查学生对数据的分析处理能力、知识迁移运用能力,题目难度中等.

| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O=2HNO3+NO | |
| B. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O | |
| C. | Cu与稀硝酸反应制取硝酸铜:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3(胶体)+3H+ |
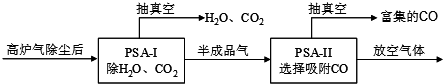
BaCl2•2H2O的流程如下:

(1)写出“浸取”环节发生的主要反应的离子方程式:BaCO3+2H+═Ba2++CO2↑+H2O实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ad.
a.烧杯 b.容量瓶 c.滴定管 d.玻璃棒
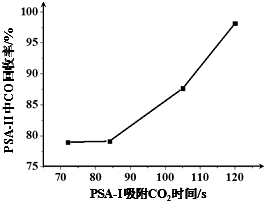
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图

①滤渣I中含Fe(OH)3(填化学式).再加入NaOH调节pH=12.5可除去Mg2+、Ca2+(填离子
符号).
②加入H2C204应避免过量的原因是H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少.
(3)25℃,H2C204和HF两种酸的电离平衡常数如下:
| H2C204 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
| HF | Ka=6.32×10-4 | |
②H2C2O4溶液和NaF溶液反应的离子方程式为H2C2O4+F-═HF+HC2O4-.
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 乙醇和水,乙醛和水,乙酸和乙醇 | |
| D. | 油脂和水,甲苯和水,乙醇和水 |
在空气中对27.45gCoC2O4•2H2O持续加热,固体的质量变化数据如下表:
| 温度范围/℃ | 120-220 | 300-350 | 450-500 | 高于600 |
| 固体/g | 22.05 | 11.25 | 11.85 | 13.05 |
②450-500℃时得到的固体物质为D(填字母).
A、CoO B、CoC2O3 C、CoO•Co2O4 D.2CoO•Co2O4.
| A. | K+、Fe2+、SO32-、MnO4- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | Al3+、S2-、Cl-、SO42- | D. | Na+、AlO2-、Br-、Cl- |