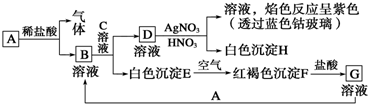
题目内容
5.某吸水材料与聚酯纤维都是重要的化工原料.它们的合成路线如图所示: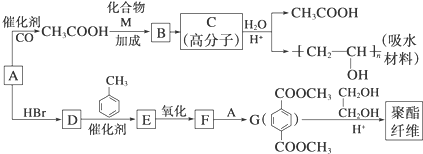
已知:
a.A由C、H、O三种元素组成,相对分子质量为32
b.RCOOR′+R″OH$\stackrel{H+}{→}$RCOOR″+R′OH(R、R′、R″代表烃基)
请回答下列问题:
(1)A的结构简式是CH3OH.
(2)B中的官能团名称是酯基和碳碳双键.
(3)D-→E的反应类型是取代反应.
(4)G-→聚酯纤维的化学方程式是
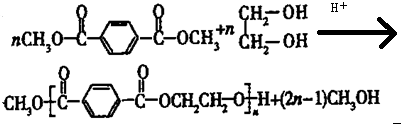 .
.(5)E的名称是对二甲苯.
(6)G的同分异构体有多种,满足下列条件的共有12种.
①苯环上只有两个取代基;
②1mol该物质与足量的NaHCO3溶液反应生成2mol CO2.
分析 A由C、H、O三种元素组成,相对分子质量为32,则A是甲醇,在催化剂条件下,甲醇和一氧化碳反应生成乙酸,乙酸和M发生加成反应生成B,B发生加聚反应生成C,根据C的水解产物知,C的结构简式为: ,B的结构简式为:CH2=CHOOCCH3;
,B的结构简式为:CH2=CHOOCCH3;
甲醇和溴化氢发生取代反应生成1-溴甲烷D,D和甲苯反应生成E,E被氧化生成F,F和甲醇反应生成G,则F是对二苯甲酸,E是对二甲苯,1-溴甲烷和和甲苯发生取代反应生成对二甲苯.
解答 解:A由C、H、O三种元素组成,相对分子质量为32,则A是甲醇,在催化剂条件下,甲醇和一氧化碳反应生成乙酸,乙酸和M发生加成反应生成B,B发生加聚反应生成C,根据C的水解产物知,C的结构简式为: ,B的结构简式为:CH2=CHOOCCH3;
,B的结构简式为:CH2=CHOOCCH3;
甲醇和溴化氢发生取代反应生成1-溴甲烷D,D和甲苯反应生成E,E被氧化生成F,F和甲醇反应生成G,则F是对二苯甲酸,E是对二甲苯,1-溴甲烷和和甲苯发生取代反应生成对二甲苯,
(1)通过以上分析知,A是甲醇,其结构简式为:CH3OH,
故答案为:CH3OH;
(2)B的结构简式为:CH2=CHOOCCH3,B中含有的官能团是碳碳双键和酯基,
故答案为:酯基和碳碳双键;
(3)1-溴甲烷和甲苯发生取代反应生成对二甲苯,故答案为:取代反应;
(4)G和乙二醇发生取代反应生成聚酯纤维,反应方程式为: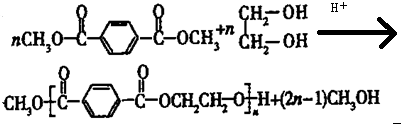 ,
,
故答案为: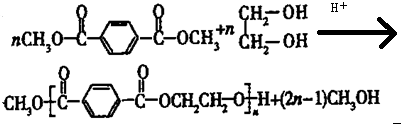 ;
;
(5)E的名称是对二甲苯,
故答案为:对二甲苯;
(6)G的同分异构体符合下列条件:①苯环上只有两个取代基,②1mol能与足量的NaHCO3,溶液反应生成2mol CO2气体,说明该分子中含有两个羧基,如果一个是甲酸基一个丙酸基,有三种结构;如果一个甲酸基一个异丙酸基,有三种结构,如果是两个乙酸基,有三种结构,如果苯环上含有一个甲基和一个-CH(COOH)2,有三种结构,所以一共有12种同分异构体,
故答案为:12.
点评 本题考查了有机物的推断,明确有机物的官能团及其性质是解本题关键,以吸水材料的结构简式及A采用正逆相结合的方法进行推断,难点是同分异构体种类的确定,注意不要重写和漏写,为易错点.

| ① | ② | ③ |
| ④ | ⑤ | ⑥ |
(2)若①的气态氢化物的水溶液呈碱性,则①在元素周期表中的位置是第二周期VA族;六种元素中,最高价氧化物对应水化物的酸性最强的是Cl(填元素符号).
若②为非金属元素,则以下推断正确的是c(选填编号)
a.①一定是金属元素 b.④一定是金属元素 c.⑥一定是非金属元素.
| A. | 达到平衡时,4v(O2)正=5v(NO)逆 | |
| B. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量之比为4:5:4:6 | |
| C. | 达到平衡状态时,若增加容器体积,则反应速率增大 | |
| D. | 若单位时间生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 |
| A. | BiONO3 | B. | (NH4)2Fe(SO4)2 | C. | Ca(ClO)Cl | D. | K3Fe(CN)6 |
 、
、 .
. .
.