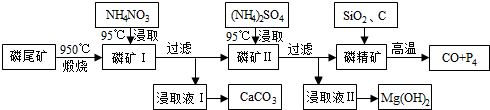
题目内容
15.已知AB3易溶于有机溶剂,不溶于水,则下列说法正确的是( )| A. | AB3是非极性分子 | B. | A原子无孤对电子 | ||
| C. | A原子为sp3杂化 | D. | AB3为三角锥形结构 |
分析 AB3易溶于有机溶剂,不溶于水,根据相似相溶原理,说明AB3是非极性分子,其结构对称,应为正三角形结构,A原子无孤对电子,A原子为sp2杂化.
解答 解:A.根据相似相溶原理,说明AB3是非极性分子,故A正确;
B.AB3是非极性分子,其结构对称,应为正三角形结构,A原子无孤对电子,故B正确;
C.AB3是非极性分子,其结构对称,应为正三角形结构,A原子无孤对电子,A原子为sp2杂化,故C错误;
D.AB3是非极性分子,其结构对称,应为正三角形结构,故D错误;
故选:AB.
点评 本题考查物质结构与性质的关系,利用相似相溶原理是解题的关键,题目难度适中.

练习册系列答案
相关题目
6.丹参素的结构简式为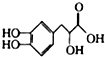 ,下列有关丹参素的说法不正确的是( )
,下列有关丹参素的说法不正确的是( )
 ,下列有关丹参素的说法不正确的是( )
,下列有关丹参素的说法不正确的是( )| A. | 分子式为C9H10O5 | B. | 能发生加成反应 | ||
| C. | 能与NaHCO3溶液反应 | D. | 能发生酯化反应和水解反应 |
10.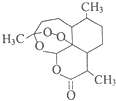 青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )
青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )
 青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )
青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )| A. | 青蒿素分子中含有醚键和酯基等官能团 | |
| B. | 青蒿素在加热时能与NaOH的水溶液反应 | |
| C. | 青蒿素易溶于水、苯等溶剂 | |
| D. | 用乙醚从青蒿中提取青蒿素,用到了萃取原理 |
20.下列各组离子在溶液中能大量共存的是( )
| A. | H+、Na+、Fe2+、NO3- | B. | Fe3+、Fe2+、SO42-、NO3- | ||
| C. | Na+、OH-、SO42-、H2PO4- | D. | Al3+、Na+、S2-、SO42- |
7.下列关于燃料的说法错误的是( )
| A. | 燃料燃烧产物CO2是温室气体之一 | |
| B. | 化石燃料完全燃烧不会造成大气污染 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | 燃料不完全燃烧排放的CO是大气污染物之一 |
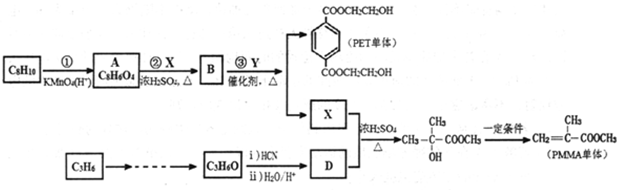
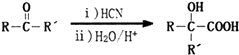
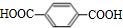 +2CH3OH$→_{△}^{浓硫酸}$
+2CH3OH$→_{△}^{浓硫酸}$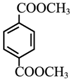 +2H2O.
+2H2O.
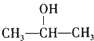 $→_{△}^{O_{2}/Cu}$
$→_{△}^{O_{2}/Cu}$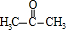 .
.
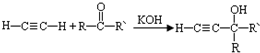
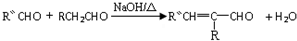 (-R、-R′、-R″表示可能相同或可能不同的原子或原子团)
(-R、-R′、-R″表示可能相同或可能不同的原子或原子团) .
. .
.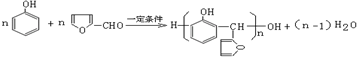 .
.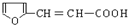 有多种同分异构体,符合下列要求的有9种.
有多种同分异构体,符合下列要求的有9种.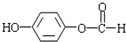 或
或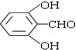 或
或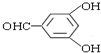 (任写一种).
(任写一种).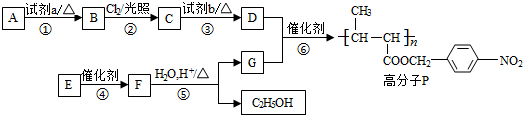
 .
. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$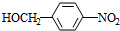 +NaCl.
+NaCl.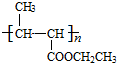 +nH2O$→_{△}^{H+}$
+nH2O$→_{△}^{H+}$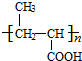 +n CH3CH2OH.
+n CH3CH2OH.