题目内容
20.下列各组离子在溶液中能大量共存的是( )| A. | H+、Na+、Fe2+、NO3- | B. | Fe3+、Fe2+、SO42-、NO3- | ||
| C. | Na+、OH-、SO42-、H2PO4- | D. | Al3+、Na+、S2-、SO42- |
分析 如离子之间不发生任何反应,如发生复分解反应生成沉淀、气体、弱电解质或发生氧化还原反应、互促水解等反应,则可大量共存,以此解答.
解答 解:A.H+、Fe2+、NO3-发生氧化还原反应而不能大量共存,故A错误;B.离子之间不发生任何反应,可大量共存,故B正确;C.OH-、H2PO4-反应生成PO43-和水,不能大量共存,故C错误;D.Al3+、S2-发生互促水解反应而不能大量共存,故D错误.故选B.
点评 本题考查离子共存问题,为高考常见题型,侧重于复分解类型、氧化还原反应以及水解的考查,注意把握常见离子的性质以及反应类型的判断,难度不大.

练习册系列答案
相关题目
11.下列根据实验现象得出的结论正确的是( )
| 实验 | 现象 | 结论 | |
| A | 将饱和食盐水滴入工业电石得到的气体通入酸性KMnO4溶液中 | KMnO4溶液紫红色褪去 | 证明生成了乙炔气体 |
| B | 将BaSO4与浓Na2CO3溶液混合后振荡静置,过滤并洗净所得的沉淀,往滴加足量盐酸 | 产生使澄清石灰水变浑浊的气体 | Ksp(BaCO3)<Ksp(BaSO4) |
| C | 充分加热花生油与NaOH混合溶液(已加沸石) | 溶液不再分层 | 花生油的水解反应已经趋于完全 |
| D | 向含KSCN的FeI2溶液中滴加足量氯水 | 溶液变为血红色 | 还原性:Fe2+>I- |
| A. | A | B. | B | C. | C | D. | D |
8.下列各组物质的溶液,不加任何试剂就能将其一一区别出来的是( )
| A. | Ba2Cl2、CuSO4、NaOH、NaCl | B. | Na2SO4、BaCl2、K2CO3、KNO3 | ||
| C. | FeCl3、NaOH、Na2SO4、Ba(NO3)2 | D. | NaCl、Na2CO3、Ca(NO3)2、H2SO4 |
15.已知AB3易溶于有机溶剂,不溶于水,则下列说法正确的是( )
| A. | AB3是非极性分子 | B. | A原子无孤对电子 | ||
| C. | A原子为sp3杂化 | D. | AB3为三角锥形结构 |
5.今有FeS和FeBr2混合物,其中Fe元素的质量分数为56%,则溴元素的质量分数为( )
| A. | 20% | B. | 15% | C. | 12% | D. | 10% |
15.下列说法正确的是( )
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 对于任何化学反应,增大压强均可使单位体积内活化分子数增多,反应速率加快 | |
| C. | 加入反应物,可增加活化分子百分数,从而增大化学反应速率 | |
| D. | 某反应的△H=100kJ•mol-1,说明正反应活化能比逆反应活化能大100kJ•mol-1 |

 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$

 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$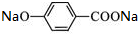 +
+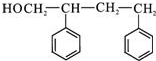 +H2O.
+H2O. (写出其中一种的结构简式).
(写出其中一种的结构简式). ,其中氮的化合价为-2.
,其中氮的化合价为-2.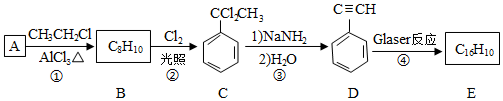
 ,D的化学名称为苯乙炔.
,D的化学名称为苯乙炔. .用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.
.用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.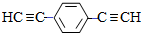 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n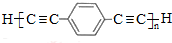 +(n-1)H2.
+(n-1)H2.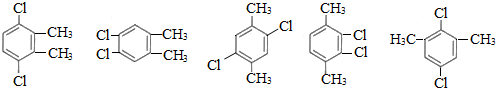 任意三种.
任意三种.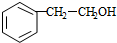 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$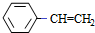 $\stackrel{Br_{2}/H_{2}O}{→}$
$\stackrel{Br_{2}/H_{2}O}{→}$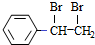 $→_{△}^{NaOH醇溶液}$
$→_{△}^{NaOH醇溶液}$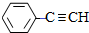 .
.