题目内容
实验是化学研究的一种重要手段,现有如图所示A-G七种仪器,请根据要求填空.
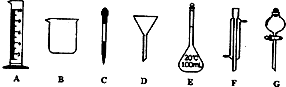
(1)写出下列仪器的名称:E ,F .
(2)下列实验操作中要用到的仪器G是 (选填编号)
a.分离水和CCl4的混合物 b.分离水和酒精的混合物 c.分离水和泥砂的混合物
(3)实验室配制100mL0.5mol/L的盐酸溶液.
①下列关于仪器E的使用方法中,正确的是 (选填编号)
a.使用前必须烘干b.使用前应检查是否漏液 c可以用作物质溶解的容器.d.热溶液可直接转移到E中
②通过计算,需用10mol/L的浓盐酸 mL,取用该体积盐酸时,需要用到上述仪器中的A和 (选填仪器的编号)
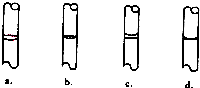
③在实验时,按下列步骤“计算→量取→溶解→转移→定容→保存到试剂瓶中”进行配制、定容后,液面位置如图所示,其中正确的是 (选填编号).所配溶液浓度将偏低的是 (选填编号).

(1)写出下列仪器的名称:E
(2)下列实验操作中要用到的仪器G是
a.分离水和CCl4的混合物 b.分离水和酒精的混合物 c.分离水和泥砂的混合物
(3)实验室配制100mL0.5mol/L的盐酸溶液.
①下列关于仪器E的使用方法中,正确的是
a.使用前必须烘干b.使用前应检查是否漏液 c可以用作物质溶解的容器.d.热溶液可直接转移到E中
②通过计算,需用10mol/L的浓盐酸
③在实验时,按下列步骤“计算→量取→溶解→转移→定容→保存到试剂瓶中”进行配制、定容后,液面位置如图所示,其中正确的是

考点:配制一定物质的量浓度的溶液,物质的分离、提纯的基本方法选择与应用
专题:
分析:(1)根据仪器的结构特点判断仪器的名称;
(2)G为分液漏斗,可用于分离互不相溶的液体混合物;
(3)①E为容量瓶,只能在常温下使用,且只能用来配制溶液,不能用作它途;
②根据0.1L×0.5mol/L=10moL/L×V计算浓盐酸浓度;粗略量取液体,可用量筒和胶头滴管;
③定容后液体凹液面与刻度线水平相切,分析不当操作V的影响,结合c=
具体分析不当操作对浓度的影响.
(2)G为分液漏斗,可用于分离互不相溶的液体混合物;
(3)①E为容量瓶,只能在常温下使用,且只能用来配制溶液,不能用作它途;
②根据0.1L×0.5mol/L=10moL/L×V计算浓盐酸浓度;粗略量取液体,可用量筒和胶头滴管;
③定容后液体凹液面与刻度线水平相切,分析不当操作V的影响,结合c=
| n |
| V |
解答:
解:(1)由仪器的图形可知E为容量瓶,F为冷凝管,故答案为:容量瓶;冷凝管;
(2)G为分液漏斗,可用于分离互不相溶的液体混合物,应为a,故答案为:a;
(3)①E为容量瓶,只能在常温下使用,且只能用来配制溶液,且使用前要检查是否漏水,故答案为:b;
②0.1L×0.5mol/L=10moL/L×V,V=0.005L,即5.0mL,取用该体积盐酸时,需要用到上述仪器中的量筒和胶头滴管,其中胶头滴管用于定容,
故答案为:5.0;C;
③定容后液体凹液面与刻度线水平相切,d符合;a、b溶液体积偏小,浓度偏大,c体积偏大,浓度偏小,故答案为:d;c.
(2)G为分液漏斗,可用于分离互不相溶的液体混合物,应为a,故答案为:a;
(3)①E为容量瓶,只能在常温下使用,且只能用来配制溶液,且使用前要检查是否漏水,故答案为:b;
②0.1L×0.5mol/L=10moL/L×V,V=0.005L,即5.0mL,取用该体积盐酸时,需要用到上述仪器中的量筒和胶头滴管,其中胶头滴管用于定容,
故答案为:5.0;C;
③定容后液体凹液面与刻度线水平相切,d符合;a、b溶液体积偏小,浓度偏大,c体积偏大,浓度偏小,故答案为:d;c.
点评:本题考查较为综合,涉及物质的分离提纯、仪器的使用、溶液的配制等知识的考查,考查学生的基本实验操作能力和实验基础知识,题目难度不大.

练习册系列答案
相关题目
对下列实验的评价,正确的是( )
| A、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、某无色溶液中滴入紫色石蕊试液显红色,该溶液一定是酸溶液 |
| C、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、验证烧碱溶液中是否含有Cl-,先加稍过量的稀硝酸除去OH-,再加入AgNO3溶液,如有白色沉淀,则证明有Cl- |