题目内容
(1)一定量的A、B在2L的密闭容器中进行反应A(g)+B(g)?2C(g),2min后,测得各物质的浓度分别为c(A)=0.5mol/L,c(B)=0.75mol/L,c(C)=0.5mol/L,则A和B起始的物质的量分别为A: 和B: .
(2)将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)═xC(g)+2D(g),经过5min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的反应速率是0.1mol/(L?min),A在5min末的浓度是 ,B的平均反应速率是 _,x的值为 .
(2)将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)═xC(g)+2D(g),经过5min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的反应速率是0.1mol/(L?min),A在5min末的浓度是
考点:化学平衡的计算
专题:
分析:(1)根据浓度变化量之比等于化学计量数之比计算A、B的浓度变化量,根据平衡浓度+浓度变化量=反应物的物质的起始浓度,据此计算A、B物质的起始浓度;
(2)根据n=cV求出D的物质的量,根据n=vtV计算出C的我知道,然后根据同一反应中转化的物质的物质的量之比等于化学计量数之比求出x值;根据v=
计算出B的反应速率;设出A、B的物质的量,根据c(A):c(B)=3:5计算出A的初始物质的量,再根据c=
计算出A的初始浓度.
(2)根据n=cV求出D的物质的量,根据n=vtV计算出C的我知道,然后根据同一反应中转化的物质的物质的量之比等于化学计量数之比求出x值;根据v=
| △c |
| △t |
| n |
| V |
解答:
解:(1)开始加入A、B两种气体,平衡时c(A)=0.5mol/L,c(B)=0.75mol/L,c(C)=0.5mol/L,
由方程式A(g)+B(g)=2C(g)可知,△c(A)=
△c(C)=
×0.5mol/L=0.25mol/L,
则△c(B)=
△c(C)=
×0.5mol/L=0.25mol/L,
故A的起始物质的量为为:(0.5mol/L+0.25mol/L)×2L=1.5mol,B物质的起始物质的量为:(0.75mol/L+0.25mol/L)×2L=2mol,
故答案为:1.5mol;2.0mol;
(2)根据题意可知生成D的物质的量为:0.5mol/L×2L=1mol,C的物质的量为:0.1mol/(L?min)×5min×2L=1mol,
所以D与C的物质的量之比为1:1,根据同一反应中转化的物质的物质的量之比等于化学计量数之比可知x=2;
反应方程式为3A(g)+B(g)?2C(g)+2D(g),
则:3A(g)+B(g)?2C(g)+2D(g),
3 1 2 2
n(A) n(B) 1mol
反应消耗的A、B的物质的量为:n(A)=
=1.5mol、n(B)=
=0.5mol,
设反应前A、B的物质的量都为nmol,则(n-1.5):(n-0.5)=3:5,解得:n=3,即:反应前A、B的物质的量都为3mol,则二者的初始浓度为:c=
=1.5mol/L;
反应速率v(B)=
=0.05 mol/(L?min);
故答案为:1.5mol/L;0.05 mol/(L?min); 2.
由方程式A(g)+B(g)=2C(g)可知,△c(A)=
| 1 |
| 2 |
| 1 |
| 2 |
则△c(B)=
| 1 |
| 2 |
| 1 |
| 2 |
故A的起始物质的量为为:(0.5mol/L+0.25mol/L)×2L=1.5mol,B物质的起始物质的量为:(0.75mol/L+0.25mol/L)×2L=2mol,
故答案为:1.5mol;2.0mol;
(2)根据题意可知生成D的物质的量为:0.5mol/L×2L=1mol,C的物质的量为:0.1mol/(L?min)×5min×2L=1mol,
所以D与C的物质的量之比为1:1,根据同一反应中转化的物质的物质的量之比等于化学计量数之比可知x=2;
反应方程式为3A(g)+B(g)?2C(g)+2D(g),
则:3A(g)+B(g)?2C(g)+2D(g),
3 1 2 2
n(A) n(B) 1mol
反应消耗的A、B的物质的量为:n(A)=
| 1mol×3 |
| 2 |
| 1mol×1 |
| 2 |
设反应前A、B的物质的量都为nmol,则(n-1.5):(n-0.5)=3:5,解得:n=3,即:反应前A、B的物质的量都为3mol,则二者的初始浓度为:c=
| 3mol |
| 2L |
反应速率v(B)=
| ||
| 5min |
故答案为:1.5mol/L;0.05 mol/(L?min); 2.
点评:本题考查了化学反应速率的计算、有关物质的量的计算,题目难度中等,注意掌握常见物理量之间的转化关系,明确化学反应速率的概念及计算方法,试题有利于提高学生的化学计算能力.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
(双选)常温下,下列各组离子一定可以大量共存的是( )
| A、强碱性溶液中:Na+、CO32-、SO32-、K+ |
| B、石蕊呈红色的溶液:ClO-、Na+、SO32-、Cl- |
| C、PH>7的溶液中:Mg2+、Br-、K+、Al3+ |
| D、加入Fe能放出H2的溶液中:Cl-、Mg2+、SO42-、K+ |
下列实验设计能完成或实验结论合理的是( )
| A、证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 |
| B、铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物 |
| C、测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
| D、用浓硫酸吸收二氧化硫中混有少量SO3气体 |
在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A、加入Al能放出H2的溶液中:Mg2+、Cu2+、SO42-、NO3- |
| B、能使酚酞变红的溶液中:K+、Na+、Cl-、CO32- |
| C、无色透明的水溶液中:K+、Ba2+、I-、MnO4- |
| D、常温下,在c(H+)/c(OH-)=1×10-12的溶液中:Fe2+、Cu2+、Cl-、NO3- |
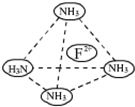 物质结构与性质A、B、C、D、E为原子序数依次增大的六种元素.已知:A是周期表中原子半径最小的元素,B的基态原子2p原子轨道上有3个未成对的电子,且B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子.
物质结构与性质A、B、C、D、E为原子序数依次增大的六种元素.已知:A是周期表中原子半径最小的元素,B的基态原子2p原子轨道上有3个未成对的电子,且B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子.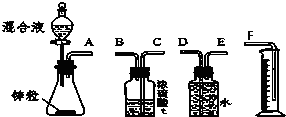 某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.为了进一步研究硫酸铜的浓度对氢气生成速率的影响,该小组同学开始了实验探究.
某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.为了进一步研究硫酸铜的浓度对氢气生成速率的影响,该小组同学开始了实验探究.
 A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.