题目内容
对下列实验的评价,正确的是( )
| A、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、某无色溶液中滴入紫色石蕊试液显红色,该溶液一定是酸溶液 |
| C、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、验证烧碱溶液中是否含有Cl-,先加稍过量的稀硝酸除去OH-,再加入AgNO3溶液,如有白色沉淀,则证明有Cl- |
考点:常见阳离子的检验,常见阴离子的检验
专题:
分析:A.根据氯化银为不溶于水、不溶于酸的白色沉淀来分析;
B.硫酸氢钠电离产生氢离子,溶液呈酸性,能够使紫色石蕊试液显红色;
C.BaCO3、CaCO3、MgCO3等白色沉淀也能溶液盐酸;
D.根据AgCl不溶于硝酸的性质判断.
B.硫酸氢钠电离产生氢离子,溶液呈酸性,能够使紫色石蕊试液显红色;
C.BaCO3、CaCO3、MgCO3等白色沉淀也能溶液盐酸;
D.根据AgCl不溶于硝酸的性质判断.
解答:
解:A.当溶液中存在大量Ag+时,加入氯化钡溶液时Ag+能与Cl-反应生成白色氯化银沉淀,所以不能肯定溶液中大量存在SO42-,故B错误;
B.硫酸氢钠电离产生氢离子,溶液呈酸性,能够使紫色石蕊试液显红色,但是硫酸氢钠属于盐,故B错误;
C.BaCO3、CaCO3、MgCO3等白色沉淀也能溶液盐酸,所以溶液中不一定有钡离子,故C错误;
D.验证烧碱溶液中是否含Cl-,先加过量的稀硝酸除去OH-,AgCl不溶于硝酸,如有白色沉淀生成,证明含Cl-,故D正确;
故选:D.
B.硫酸氢钠电离产生氢离子,溶液呈酸性,能够使紫色石蕊试液显红色,但是硫酸氢钠属于盐,故B错误;
C.BaCO3、CaCO3、MgCO3等白色沉淀也能溶液盐酸,所以溶液中不一定有钡离子,故C错误;
D.验证烧碱溶液中是否含Cl-,先加过量的稀硝酸除去OH-,AgCl不溶于硝酸,如有白色沉淀生成,证明含Cl-,故D正确;
故选:D.
点评:本题考查化学实验方案的评价,涉及离子的检验、酸碱指示剂的变色及物质的性质等,明确物质的性质是解题关键,注意排除离子的干扰的现象,注意实验的严密性.

练习册系列答案
相关题目
下列实验设计能完成或实验结论合理的是( )
| A、证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 |
| B、铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物 |
| C、测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
| D、用浓硫酸吸收二氧化硫中混有少量SO3气体 |
下列说法正确的是( )
| A、在任何条件下,纯水都呈中性 |
| B、pH<7的溶液一定呈酸性 |
| C、25℃时,纯水和稀酸溶液中水的离子积常数不相符 |
| D、pH均等于6的NH4Cl溶液和CH2COOH溶液中,水的电离程度相同 |
某化合物由碳、氢、氧三种元素组成,其红外光谱图有C-H键、O-H键、C-O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式可能是( )
| A、CH3CH2OCH3 |
| B、CH3COOH |
| C、CH3CH2CH2OH |
| D、CH3CH2CHO |
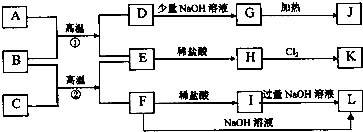
 已知A、B、C是常见的单质,在一定条件下相互转化的关系如图所示(有部分物质省略)
已知A、B、C是常见的单质,在一定条件下相互转化的关系如图所示(有部分物质省略)