题目内容
已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,下列叙述正确的是( )
| A、2个氢分子和1个氧分子反应生成2个水分子,放出热量571.6 kJ |
| B、2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),吸收热量571.6 kJ |
| C、2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ |
| D、2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),放出热量571.6 kJ |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:根据2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol表示2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),放出热量571.6 kJ,即可解答.
解答:
解:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol表示2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),放出热量571.6 kJ,则2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ,故选C.
点评:本题考查热化学方程式的意义,题目难度不大,注意热化学方程式的意义理解.

练习册系列答案
相关题目
下列反应常温时能自发进行,并既能用能量判据又能用熵判据解释的是( )
| A、HCl+NH3=NH4Cl |
| B、2Na+2H2O=2NaOH+H2↑ |
| C、2KClO3=2KCl+3O2↑ |
| D、Ba(OH)2?8H2O+2 NH4Cl=BaCl2+NH3↑+10H2O |
 黄曲霉素的结构如下,1mol该化合物分别与H2、NaOH溶液反应最多消耗H2和NaOH的物质的量分别为( )
黄曲霉素的结构如下,1mol该化合物分别与H2、NaOH溶液反应最多消耗H2和NaOH的物质的量分别为( )| A、6mol,1mol |
| B、7mol,1mol |
| C、6mol,2mol |
| D、7mol,2mol |
下列有关实验操作或试剂贮存方法叙述正确的是( )
| A、配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,再用水稀释到所需浓度 |
| B、实验室可将氯气溶于水配制成氯水长期保存,随时取用 |
| C、氢氟酸用玻璃瓶密封贮存 |
| D、NaOH溶液用磨口玻璃瓶加玻璃塞封存 |
下列关于常见有机化合物的说法中,正确的是( )
| A、乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 |
| B、甲烷和苯都能发生氧化反应和取代反应 |
| C、乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
在水溶液中能大量共存的一组是( )
| A、Fe2+ Al3+ ClO- Cl- |
| B、K+Fe3+OH- NO3- |
| C、NH4+ Na+ Br- SO42- |
| D、Na+ H+ SiO32- SO42- |
某气体可能含有N2、HCl、CO中的一种或几种,将其依次通入足量NaHCO3溶液和灼热CuO,气体的体积都没有变化,再通过足量的碱石灰,气体体积减小,但还有剩余气体,以下对该气体组分判断正确的是( )
| A、一定没有N2,CO和HCl至少有1种 |
| B、一定有N2,HCl和CO |
| C、一定有N2,CO和HCl至少有1种 |
| D、一定有N2和CO,没有HCl |
某有机物结构简式如图所示(未表示出其空间构型).下列它的性质描述不正确的是( )
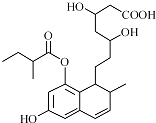

| A、能与FeCl3 溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1mol该物质最多可与3mol NaOH反应 |