题目内容
5.下列说法正确的是( )| A. | 活化分子间所发生的碰撞都为有效碰撞 | |
| B. | 合成氨工业中用铁触媒做催化剂能用勒夏特列原理解释 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子的百分数 | |
| D. | 将钢闸门与电源的正极相连,是采用了外加电流的阴极保护法 |
分析 A.活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞;
B.勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关、与平衡移动无关,则不能用勒夏特利原理解释;
C.升高温度,活化分子百分数增加,化学反应速率增大;
D.采用外加电流的阴极保护法保护金属时,被保护的金属作阴极.
解答 解:A.活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞,故A错误;
B.催化剂只是影响反应速率,不能用勒夏特列原理解释,故B错误;
C.升高温度,增加了单位体积内活化分子百分数,化学反应速率一定能够增大,故C正确;
D.采用外加电流的阴极保护法保护金属时,被保护的金属作阴极,所以钢闸门与电源的负极相连,故D错误;
故选C.
点评 本题考查学生影响化学反应速率的因素中的温度、浓度因素、电解池原理的分析应用,可以根据所学知识进行回答,难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
17.下列所述反应的方程式书写正确的是( )
| A. | 常温下,0.1 mol•L-1 HA溶液的pH=3,则HA的电离:HA=H++A- | |
| B. | 用铜电极电解饱和硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向1 mL 2 mol•L-1NaOH溶液中滴加1~2滴0.1 mol•L-1MgCl2溶液后,再滴加2滴0.1 mol•L-1 FeCl3溶液:Mg2++2OH-═Mg(OH)2↓,3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 钢铁发生吸氧腐蚀生成铁锈:2Fe+O2+2H2O═2Fe(OH)2,4Fe(OH)2+O2+2H2O═4Fe(OH)3,2Fe(OH)3═Fe2O3•xH2O+(3-x)H2O |
15.二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,.
回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
(2)滤渣B的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+,Zn2+杂质,可能原因是CuS、ZnS的溶解度较MnS小.
(4)碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:Zn+2MnO2+2H2O═Zn(OH)2+2MnOOH,该电池的正极反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-.

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,.
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 |
| 沉淀物 | CuS | ZnS | MnS | FeS | ||
| Ksp | 8.5×10-45 | 1.2×10-23 | 1.4×10-15 | 3.7×10-14 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
(2)滤渣B的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+,Zn2+杂质,可能原因是CuS、ZnS的溶解度较MnS小.
(4)碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:Zn+2MnO2+2H2O═Zn(OH)2+2MnOOH,该电池的正极反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-.
10.如图为铜锌原电池的示意图,下列有关的说法中不正确的是( )
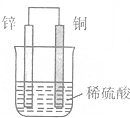

| A. | 锌片上有H2逸出 | B. | 溶液中c(H+)逐渐减小 | ||
| C. | 正极反应式:2H++2e-═H2↑ | D. | 负极反应式:Zn-2e-═Zn2+ |
17.有文献报道,硫在空气中燃烧时,产物中SO3约占5%~6%(体积比,下同),而硫在纯氧气中燃烧时,其产物中的SO3约占2%~3%,解释这一事实的理由正确的是( )
| A. | 在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动 | |
| B. | 在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生成SO3的方向移动 | |
| C. | 在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响 | |
| D. | 没有使用催化剂 |
14.比较是化学学习中的一种重要方法.下列各组比较中不正确的是( )
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 还原性:I->Br->Cl->F- | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸氢钠溶液与稀盐酸互滴时两种操作现象相同 |
15.下列说法正确的是( )
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$的值及SO2转化率不变 |