题目内容
14.比较是化学学习中的一种重要方法.下列各组比较中不正确的是( )| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 还原性:I->Br->Cl->F- | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸氢钠溶液与稀盐酸互滴时两种操作现象相同 |
分析 A.相同条件下,NaHCO3溶解度较小;
B.同主族元素的非金属性越强,对应的阴离子的还原性越弱;
C.元素的非金属性越强,对应的单质的氧化性越强;
D.碳酸氢钠和盐酸反应只生成二氧化碳和水.
解答 解:A.相同条件下,NaHCO3溶解度较小,在饱和碳酸钠溶液中通入过量的二氧化碳气体可得到碳酸氢钠沉淀,故A错误;
B.非金属性F>Cl>Br>I,同主族元素的非金属性越强,对应的阴离子的还原性越弱,故B正确;
C.非金属性F>Cl>Br>I,元素的非金属性越强,对应的单质的氧化性越强,故C正确;
D.盐酸与碳酸氢钠反应与滴加顺序无关,反应都生成氯化钠和二氧化碳、水,现象相同,故D正确.
故选A.
点评 本题考查钠的重要化合物以及元素周期律知识,侧重于学生的分析能力的考查,为高频考点,注意把握元素化合物的性质以及元素周期律的递变规律,难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
6.在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
| A. | Fe3+、Al3+ | B. | Fe3+ | C. | Fe2+、NH4+ | D. | Al3+ |
5.下列说法正确的是( )
| A. | 活化分子间所发生的碰撞都为有效碰撞 | |
| B. | 合成氨工业中用铁触媒做催化剂能用勒夏特列原理解释 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子的百分数 | |
| D. | 将钢闸门与电源的正极相连,是采用了外加电流的阴极保护法 |
2.将0.02molNa分别投入到盛有100mL水、100 mL 1mol•L-1盐酸、100mL 1mol•L-1硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )
| A. | 三个烧杯中一定均会发生的离子反应有:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 三个烧杯中钠均在液面上剧烈反应 | |
| C. | Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 | |
| D. | 三个烧杯中生成氢气的物质的量相同 |
19.反应:aL(s)+bG(g)?cR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,
x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )

x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )

| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a+b>c | D. | a+b<c |
6.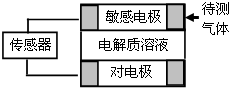 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图.气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图.气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图.气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图.气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )| 待测气体 | 部分电极产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| SO2 | H2SO4 |
| A. | 上述气体检测时,敏感电极均作电池负极 | |
| B. | 检测分别含SO2和CO体积分数相同的两份体积相同的空气样本时,传感器上产生的电流大小相同 | |
| C. | 检测CO时,敏感电极上的电极反应式为CO+2OH--2e-═CO2+H2O | |
| D. | 检测NO2时,电解质溶液可选NaOH溶液 |
3.下列说法正确的是( )
| A. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| B. | 海水资源的利用包括水资源的利用和化学资源的利用,两者可以综合进行 | |
| C. | 工业上用电解饱和氯化钠溶液的方法制得金属钠 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水体污染 |
 .
.