题目内容
10. 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)仔细观察实验装置,图中是否缺少一种玻璃用品,如果缺少,缺少的是环形玻璃搅拌棒(填仪器名称,如果不缺少,此空不填.),图中是否有不妥之处,如果有请指出大小烧杯口不齐平(如果没有,此空不填.)
(2)烧杯间填满碎纸条的作用是保温防止热量损失.
(3)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”)
(4)用相同浓度和体积的醋酸代替盐酸溶液进行上述实验,测得的中和热△H的数值会偏小;(填“偏大”、“偏小”、“无影响”).
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”).
分析 (1)图中缺少搅拌仪器,且大小烧杯口不相平,热量散失;
(2)烧杯间填满碎纸条起保温作用;
(3)大烧杯上如不盖硬纸板,热量散失,测定热量偏小;
(4)醋酸电离吸热;
(5)物质的量与热量成正比,但生成1mol时时热量为中和热,以此来解答.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;图中不妥之处为大小烧杯口不齐平,
故答案为:环形玻璃搅拌棒;大小烧杯口不齐平;
(2)烧杯间填满碎纸条的作用是保温防止热量损失,
故答案为:保温防止热量损失;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,
故答案为:偏小;
(4)醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替稀盐酸溶液反应,反应放出的热量小于57.3kJ,但焓变为负,则△H>-57.3kJ/mol,
故答案为:偏小;
(5)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL 0.50mol/L 盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,
故答案为:不相等;相等.
点评 本题考查中和热测定实验,为高频考点,把握测定原理、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意中和热的数值及焓变关系,题目难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
1.下列实验操作中正确的是( )
| A. | 碘单质受热易升华,用加热法可以分离高锰酸钾和碘单质的混合物 | |
| B. | 分液时,分液漏斗内的上下层液体应分别都从下口放出 | |
| C. | 向溴水中加入苯,充分振荡后静置,上层无色,下层橙红色 | |
| D. | 配制100 g10%的CuSO4溶液,称取10 g硫酸铜固体溶于90 g水中 |
5.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)?Y(g)+Z(s),以下不能作为反应达到平衡标志的是( )
| A. | X的分解速率是Y的消耗速率的2倍 | |
| B. | 混合气体的压强不再变化 | |
| C. | 单位时间内生成l mol Y的同时分解2 mol X | |
| D. | 混合气体的密度不再变化 |
15.以NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,32gO2含2NA个原子 | |
| B. | 标准状况下,11.2LH2O含有的原子数目为1.5NA | |
| C. | 1mol的Cl-含有NA个电子 | |
| D. | 0.5mol/L的NaCl溶液中Cl-的个数为0.5 NA |
2. 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
若平衡表达式为K=$\frac{c(H_{2})•c(CO)}{c(H_{2}O)}$,则它所对应的化学反应方程式是(填序号)③.
(2)对反应①下列说法中能说明该反应达到平衡状态的bcd
a.温度和体积一定时,混合气体的颜色不再变化
b.温度和体积一定时,容器内的压强不再变化
c.温度和体积一定时,生成物的浓度不再变化
d.温度和体积一定时,混合气体的密度不再变化
(3)不同温度下反应②的平衡常数如下表所示.则△H2<0(填“<”或“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol•L-1、c(H2)=0.015mol•L-1,则CO的平衡转化率为75%.
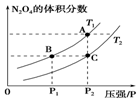
(4)对反应2NO2(g)?N2O4(g)△H<0在温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示.
则T1<T2(填“>”或“<”);增大压强,平衡正反应方向移动(填“正反应方向”或“逆反应方
向”或“不”); B、C两点的平衡常数B>C(填“>”或“<”).
 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
若平衡表达式为K=$\frac{c(H_{2})•c(CO)}{c(H_{2}O)}$,则它所对应的化学反应方程式是(填序号)③.
(2)对反应①下列说法中能说明该反应达到平衡状态的bcd
a.温度和体积一定时,混合气体的颜色不再变化
b.温度和体积一定时,容器内的压强不再变化
c.温度和体积一定时,生成物的浓度不再变化
d.温度和体积一定时,混合气体的密度不再变化
(3)不同温度下反应②的平衡常数如下表所示.则△H2<0(填“<”或“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol•L-1、c(H2)=0.015mol•L-1,则CO的平衡转化率为75%.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.945795506 | 9 | 1 |
则T1<T2(填“>”或“<”);增大压强,平衡正反应方向移动(填“正反应方向”或“逆反应方
向”或“不”); B、C两点的平衡常数B>C(填“>”或“<”).
5.将一定量的 SO2(g)和 O2(g)分别通入到体积为 2L 的恒容密闭容器中,在不同温度下进 行反应得到如表中的两组数据:下列说法不正确的是( )
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
| A. | x=1.6 | |
| B. | 实验 1 在前 6min 的反应速率 v(SO2)=0.2mol•L-1•min-1 | |
| C. | T1、T2的关系:T1>T2 | |
| D. | K1、K2的关系:K1>K2 |