题目内容
19.在标准状况下,由CO和CO2组成的混合气体为6.72L,质量为12g,则该混合气体的平均相对分子质量是40,CO的质量是2.1g.分析 混合气体的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,设CO为xmol,CO2为ymol,则
$\left\{\begin{array}{l}{x+y=0.3}\\{28x+44y=12}\end{array}\right.$,
以此来解答.
解答 解:混合气体的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,
该混合气体的平均相对分子质量是$\frac{12}{0.3}$=40,
设CO为xmol,CO2为ymol,则
$\left\{\begin{array}{l}{x+y=0.3}\\{28x+44y=12}\end{array}\right.$,
解得x=0.075mol,
则CO的质量为0.075mol×28g/mol=2.1g,
故答案为:40;2.1.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Ca2+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 水电离出的c(H+)=10-13mol•L-1的溶液中:K+、Na+、SO42-、AlO2- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
10.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.
供选择的化学试剂及实验方法
A.取样,滴加过量氢氧化钠溶液
B.向溶液中通入足量二氧化碳
C.加水溶解、过滤、结晶
D.取样,滴加稀硫酸.
| 实验目的 | 试剂及方法 |
| 证明炭粉中含有CuO | |
| 鉴别MgCl2和AlCl3溶液 | |
| 分离Na2SO4和CaCO3固体混合物 | |
| 除去NaHCO3溶液中混有的Na2CO3 |
A.取样,滴加过量氢氧化钠溶液
B.向溶液中通入足量二氧化碳
C.加水溶解、过滤、结晶
D.取样,滴加稀硫酸.
7.宁波气象信息网2011年10月26日13点55分发布环境空气质量实时报告,其中空气污染指数为39,首要污染物为可吸入颗粒物,下列分析不正确的是( )
| A. | 空气质量等级为优 | |
| B. | 二氧化硫的污染指数可能为42 | |
| C. | 目前,我国大部分地区空气中二氧化硫、二氧化氮及可吸入颗粒物等物质的含量偏高 | |
| D. | 对煤、石油等燃料进行脱硫处理、使用氢气等清洁燃料、通过静电沉降器除去悬浮颗粒物都可以治理大气污染,改善空气质量 |
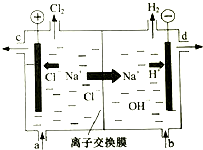 工业中的氯碱工业是离子交换膜法电解精制饱和食盐水如下图,离子交换膜只允许阳离子通过.
工业中的氯碱工业是离子交换膜法电解精制饱和食盐水如下图,离子交换膜只允许阳离子通过.