题目内容
14.下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见物质.其中,B、E为金属单质,D为气体.反应①②是置换反应,反应①②③均在高温下进行.A为常温下最常见的液体,B、C都有磁性,E、F既能溶于NaOH又能溶于HCl.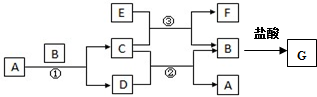
(1)C的化学式Fe3O4,C与足量盐酸反应的化学方程式Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(2)反应③化学方程式3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;E加入过量的NaOH溶液对应离子反应方程式2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)G溶液中加入酸性的H2O2溶液后变黄色,对应离子反应方程式2Fe2++2H++H2O2=2Fe3++2H2O;.
(4)纯净G的溶液中金属阳离子检验方法向溶液中加入KSCN溶液,无明显现象,再加入氯水,变成红色;向G溶液中加入NaOH溶液后的现象是生成白色沉淀,迅速变成灰绿色,再变成红褐色.
分析 B为金属,且有磁性,在高温下与常见液体A反应生成一种气体D和有磁性的C,故B为Fe,A为水,C为四氧化三铁,D为氢气;
四氧化三铁与氢气在高温下反应生成水和铁;
E、F既能溶于NaOH又能溶于HCl,且E为一种金属,则E为铝,铝与四氧化三铁反应生成铁和氧化铝,故F为氧化铝;
Fe与盐酸反应生成氯化亚铁和氢气,故G为氯化亚铁.据此解答.
解答 解:B为金属,且有磁性,在高温下与常见液体A反应生成一种气体D和有磁性的C,故B为Fe,A为水,C为四氧化三铁,D为氢气;
四氧化三铁与氢气在高温下反应生成水和铁;
E、F既能溶于NaOH又能溶于HCl,且E为一种金属,则E为铝,铝与四氧化三铁反应生成铁和氧化铝,故F为氧化铝.
(1)由上分析,C为Fe3O4,与盐酸反应的化学方程式为,Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,故答案为:Fe3O4;Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(2)反应③化学方程式为3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,Al加入过量的NaOH溶液对应离子反应方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)2Fe2++2H++H2O2=2Fe3++2H2O,溶液中加入酸性的H2O2溶液后变黄色,对应离子反应方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(4)纯净FeCl2的溶液中Fe2+离子检验方法为向溶液中加入KSCN溶液,无明显现象,再加入氯水,变成红色,证明有Fe2+离子,向FeCl2溶液中加入NaOH溶液后的现象是先生成白色沉淀,迅速变成灰绿色,再变成红褐色.
故答案为:向溶液中加入KSCN溶液,无明显现象,再加入氯水,变成红色;生成白色沉淀,迅速变成灰绿色,再变成红褐色.
点评 本题以无机框图题的形式考查Fe、Al等元素单质及其化合物之间的相互转化关系、化学用语的书写等,难度中等,本题中A在常温下为液态,C有磁性,F既能溶于NaOH又能溶于HCl为解题突破口.

 期末集结号系列答案
期末集结号系列答案| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl是非电解质 | |
| B. | NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2均是电解质 | |
| C. | 强电解质在固态或液态时,可能不导电 | |
| D. | 铜、石墨均导电,所以它们是电解质 |
| A. | NaHRO3溶液中(R表示S或C):c(Na+)>c(HRO3-)>c(OH-)>c(H+)>c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② | |
| D. | 等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数:N前>N后 |
| A. | 2FeCl3+S2-═2FeCl2+S↓ | B. | 2FeCl3+H2S═2FeCl2+S↓+2H++2Cl- | ||
| C. | 2Fe3++S2-═2Fe2++S↓ | D. | 2Fe3++H2S═2Fe2++S↓+2H+ |
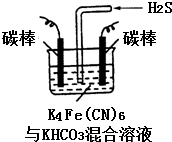 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.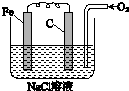 金属腐蚀的电化学原理可用如图模拟.
金属腐蚀的电化学原理可用如图模拟.