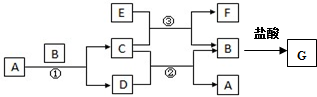
题目内容
2.下列说法正确的是( )| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl是非电解质 | |
| B. | NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2均是电解质 | |
| C. | 强电解质在固态或液态时,可能不导电 | |
| D. | 铜、石墨均导电,所以它们是电解质 |
分析 A、在水溶液里或熔融状态下能导电的化合物是电解质;
B、溶于水能导电的物质不一定是电解质;
C、多数的电解质固体不能导电;
D、单质既不是电解质也不是非电解质.
解答 解:A、液态HCl、固态NaCl均不导电,原因是液态氯化氢和固态氯化钠中不含自由移动的阴阳离子,HCl、NaCl溶于水后能电离出自由移动的阴阳离子而使其水溶液导电,所以氯化氢和氯化钠是电解质,故A错误;
B、NH3、CO2的水溶液均能导电原因是氨气、二氧化碳分别和水反应生成氨水、碳酸,氨水、碳酸等能电离出自由移动的阴阳离子而使其水溶液导电,电离出阴阳离子的是氨水和碳酸不是氨气和二氧化碳,所以氨气和二氧化碳是非电解质,Cl2是单质既不是电解质也不是非电解质,故B错误;
C、氯化钠固体不能导电,属于电解质,故C正确;
D、铜、石墨能导电,但铜和石墨是单质,所以既不是电解质也不是非电解质,故D错误.
故选C.
点评 本题考查了电解质和非电解质的判断,难度不大,注意电解质不一定能导电,能导电的物质不一定是电解质.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
13.关于图中各装置的叙述不正确的是( )
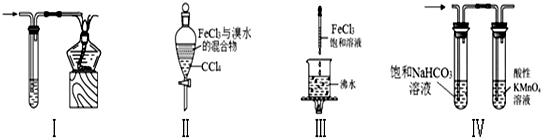

| A. | 装置Ⅰ:可用于处理CO尾气 | |
| B. | 装置Ⅱ:充分振荡后静置,下层溶液为红棕色,上层无色 | |
| C. | 装置Ⅲ:当液体呈红褐色,停止加热,让光束通过体系可产生丁达尔效应 | |
| D. | 装置Ⅳ:可用于除去CO2气体中的HCl和SO2气体 |
11.常温下,下列各组离子在指定的条件下一定能大量共存的是( )
| A. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| B. | 在pH=2的溶液中:NH4+、K+、ClO-、Cl- | |
| C. | 在c(H+)/c(OH-)=10-12的溶液中:K+、Na+、C1O-、NO3- | |
| D. | 水电离c(H+)=10-12的溶液中:Mg2+、Cu2+、SO42+、K+ |

 草酸(H2C2O4)是一种还原性二元酸,存在于菠菜等植物中.已知常温下,草酸的电离常数K1=5.4×10-2,K2=5.4×10-5.溶度积常数:草酸钙Ksp(CaC2O4)=4.0×10-8,Ksp(CaSO4)=7.10×10-9.请回答下列问题:
草酸(H2C2O4)是一种还原性二元酸,存在于菠菜等植物中.已知常温下,草酸的电离常数K1=5.4×10-2,K2=5.4×10-5.溶度积常数:草酸钙Ksp(CaC2O4)=4.0×10-8,Ksp(CaSO4)=7.10×10-9.请回答下列问题: