题目内容
19.用NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 10g 46%的乙醇溶液所含氢原子数为1.2NA | |
| B. | 0.5mol Na2O2中含有的离子数目为2NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4g,其中所含硫原子数为1.4NA |
分析 A、乙醇溶液中除了乙醇外,水也含H原子;
B、过氧化钠由2个钠离子和1个过氧根构成;
C、标况下甲醇为液体;
D、S2和S8均由S原子构成.
解答 解:A、乙醇溶液中除了乙醇外,水也含H原子,10g 46%的乙醇溶液中含有的乙醇的质量为4.6g,物质的量为0.1mol,则含0.6NA个H原子;水的质量为5.4g,物质的量为0.3mol,则含0.6NA个H原子,故共1.2NA个H原子,故A正确;
B、过氧化钠由2个钠离子和1个过氧根构成,故0.5mol过氧化钠中含有1.5NA个离子,故B错误;
C、标况下甲醇为液体,故不能根据气体摩尔体积来计算其物质的量和含有的C-H键个数,故C错误;
D、S2和S8均由S原子构成,故38.4g混合物中含有的硫原子的物质的量为n=$\frac{38.4g}{16g/mol}$=2.4mol,故个数为2.4NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
11.X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的( )
| X | Y | ||
| Z | W |
| A. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| B. | 原子半径由小到大的顺序为:X<Z<Y<W | |
| C. | 与同浓度的盐酸反应,Z比W更剧烈 | |
| D. | X的氧化物是碱性氧化物 |
4.在直流电的作用下,锌板上镀铜时,金属铜作( )
| A. | 阳极 | B. | 阴极 | C. | 正极 | D. | 负极 |

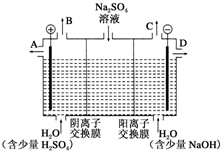 芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.