题目内容
烧碱、醋酸和醋酸钠等是生活中的常见物质.下列有关它们的表述正确的是( )
| A、将烧碱逐滴加入醋酸溶液中至溶液呈中性,则该混合液中还有少量醋酸未被中和 |
| B、将0.1 mol?L-1 CH3COOH溶液加水稀释,在此过程中,醋酸的电离程度、H+浓度都逐渐增大 |
| C、将醋酸逐滴加入醋酸钠溶液中至溶液呈酸性,则该溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、常温下,将pH=12的烧碱溶液与pH=2的醋酸溶液等体积混合,所得混合液的pH>7 |
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、醋酸钠溶液显碱性;
B、加水稀释醋酸,其酸性减弱;
C、依据电荷守恒分析;
D、醋酸是弱酸不能完全电离,所得溶液是醋酸钠和醋酸的混合溶液,显酸性.
B、加水稀释醋酸,其酸性减弱;
C、依据电荷守恒分析;
D、醋酸是弱酸不能完全电离,所得溶液是醋酸钠和醋酸的混合溶液,显酸性.
解答:
解:A、醋酸钠溶液显碱性,烧碱逐滴加入醋酸溶液中至溶液呈中性,必须使醋酸过量,故A正确;
B、加水稀释醋酸,其酸性减弱,H+浓度逐渐减小,故B错误;
C、若溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-),则电荷不守恒,应为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D、醋酸是弱酸不能完全电离,所得溶液是醋酸钠和醋酸的混合溶液,显酸性,故D错误;
故选A.
B、加水稀释醋酸,其酸性减弱,H+浓度逐渐减小,故B错误;
C、若溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-),则电荷不守恒,应为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D、醋酸是弱酸不能完全电离,所得溶液是醋酸钠和醋酸的混合溶液,显酸性,故D错误;
故选A.
点评:本题考查了盐类水解、稀释弱电解质时离子浓度变化、电荷守恒,注意:当氢离子浓度与氢氧根离子浓度相同的酸碱溶液等体积混合时,谁弱显谁性.

练习册系列答案
相关题目
下列说法中,正确的是( )
| A、石油的主要成分是烃,煤经过分馏可制得焦炭、煤焦油等产品 |
| B、棉花、麻、蚕丝在一定条件下都能发生水解反应,主要成分是纤维素 |
| C、乙酸和乙醇可以发生酯化反应又都可以与钠发生置换反应 |
| D、乙烯和苯均能使溴水退色,都发生了加成反应 |
下列叙述不正确的是( )
| A、闪电时,空气中的氮气直接转化为二氧化氮 |
| B、实验室可用浓硫酸干燥二氧化硫 |
| C、不能用稀硝酸和活泼金属反应制氢气 |
| D、将足量二氧化硫通入酸性高锰酸钾试液中,溶液褪色说明二氧化硫具有还原性 |
下列叙述正确的是( )
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7,c(SO42-)=c(NH4+) | ||
| B、两种醋酸溶液物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | ||
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | ||
D、向0.1moL?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
下列各式中属于正确的水解反应离子方程式的是( )
| A、NH4++H2O?NH3?H2O+H+ |
| B、S2-+2H2O?H2S+2OH- |
| C、CH3COOH+H2O?CH3COO-+H3O+ |
| D、HS-+H3O+?H2S+H2O |
下列溶液一定呈中性的是( )
| A、pH=7的溶液 |
| B、c(H+)=c(OH-)=10-6mol/L溶液 |
| C、酸与碱恰好完全反应生成正盐的溶液 |
| D、加入酚酞试剂呈无色的溶液 |
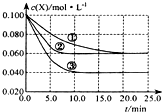 溶液中的反应:X+Y?2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如图所示.②、③与①比较只有一个实验条件不同,下列说法不正确的是( )
溶液中的反应:X+Y?2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如图所示.②、③与①比较只有一个实验条件不同,下列说法不正确的是( )| A、前5min实验③的平均反应速率最快 |
| B、条件②的反应最先达到平衡 |
| C、②与①比较可能是压强更大 |
| D、该反应的正反应是吸热反应 |
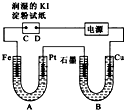 电解装置如图所示.图中B装置盛1L3mol?L-1K2SO4溶液,A装置中盛1L3mol?L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:
电解装置如图所示.图中B装置盛1L3mol?L-1K2SO4溶液,A装置中盛1L3mol?L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答: (1)如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为
(1)如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为