题目内容
在一定体积的密闭容器中,进行如下的化学反应CO2(g)+H2(g)?CO(g)+H2O(g),其中
=K,K被称为化学平衡常数,其中K和温度的关系如下表:根据以上信息推断以下说法正确的是( )
| [CO]×[H20] |
| [CO2]×[H2] |
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、此反应为放热反应 |
| B、此反应只有达到平衡时,密闭容器中的压强才不会变化 |
| C、此反应达到1000℃时的反应速率比700℃时大 |
| D、该反应的化学平衡常数越大,反应物的转化率越低 |
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:该反应是一个反应前后气体体积不变的可逆反应,压强只改变反应速率但不影响平衡移动,根据表格知,升高温度,化学平衡常数增大,说明升高温度该反应向正反应方向移动,则正反应是吸热反应,据此解答.
解答:
解:A、正反应吸热,故A错误;
B、反应前后气体体积不变,压强始终不变,故B错误;
C、温度越高反应速率越快,故C正确;
D、化学平衡常数越大,反应物的转化率越高,故D错误;
故选C.
B、反应前后气体体积不变,压强始终不变,故B错误;
C、温度越高反应速率越快,故C正确;
D、化学平衡常数越大,反应物的转化率越高,故D错误;
故选C.
点评:本题考查化学平衡的判断、温度对反应速率的影响等知识点,注意该反应的特点,压强对该反应的平衡移动无影响,为易错点.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
下列各式中属于正确的水解反应离子方程式的是( )
| A、NH4++H2O?NH3?H2O+H+ |
| B、S2-+2H2O?H2S+2OH- |
| C、CH3COOH+H2O?CH3COO-+H3O+ |
| D、HS-+H3O+?H2S+H2O |
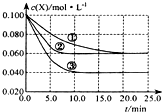 溶液中的反应:X+Y?2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如图所示.②、③与①比较只有一个实验条件不同,下列说法不正确的是( )
溶液中的反应:X+Y?2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如图所示.②、③与①比较只有一个实验条件不同,下列说法不正确的是( )| A、前5min实验③的平均反应速率最快 |
| B、条件②的反应最先达到平衡 |
| C、②与①比较可能是压强更大 |
| D、该反应的正反应是吸热反应 |
下列实验操作,能有效改变反应速率且达到变化要求的是( )
| A、为增大泡沫灭火器中Al2(SO4)3与小苏打的反应速率,改用小苏打和苏打的混合物 |
| B、为加快盐酸和锌制取氢气的速率又不减少氢气的量,可加少量硝酸银溶液 |
| C、在稀硫酸和铁粉反应制取氢气时,为减慢反应速率,可以加入适量醋酸钠 |
| D、用3 mL乙醇、2 mL浓H2SO4、2 mL冰醋酸制乙酸乙酯,为增大反应速率,可改用6 mL乙醇、4 mL浓H2SO4、4 mL冰醋酸 |
下列图示与对应的叙述相符的是( )


| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000 mol?L-1NaOH溶液滴定20.00mL0.1000 mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D、图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v逆>v正 |
朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾形成的种种美景的本质原因是( )
| A、空气中的小水滴颗粒直径大小约为1nm~100nm |
| B、光是一种胶体 |
| C、雾是一种胶体 |
| D、发生丁达尔效应 |
 一定质量的理想气体,经过如图所示的由A经B到C的状态变化.设状态A的温度为400K.求:
一定质量的理想气体,经过如图所示的由A经B到C的状态变化.设状态A的温度为400K.求: