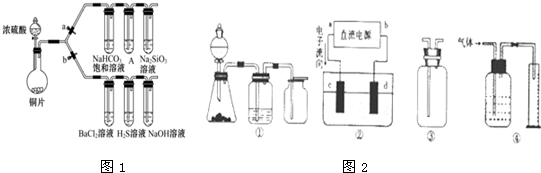
题目内容
A、B、C、D、E、F都是短周期元素,原子序数依次增大.
(1)D2C2的电子式 ;该物质属于 (晶体类型)
(2)沸点:A2C A2E(填“>”或“<”或“=”);
(3)E的非金属性比F (填“强”或“弱”),举例(用化学方程式)说明 ;
(4)化合物甲由A、B、C、D四种元素组成,其化学式量为84,是焙制糕点所用发酵粉的主要成分之一.写出甲在水溶液中与盐酸反应的离子方程式 .
| 元素 | 有关信息 |
| A | 原子最外层电子数和电子层数相等 |
| B | 原子的最外层电子数是内层电子总数的2倍 |
| C | 元素主要化合价为-2,原子半径为66pm |
| D | 与A同主族,最高价氧化物对应的水化物易溶于水 |
| E | 原子半径为104pm,所在主族序数与所在周期序数之差为3 |
| F | 单质为有色的气体 |
(2)沸点:A2C
(3)E的非金属性比F
(4)化合物甲由A、B、C、D四种元素组成,其化学式量为84,是焙制糕点所用发酵粉的主要成分之一.写出甲在水溶液中与盐酸反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F都是短周期元素,原子序数依次增大;A原子最外层电子数和电子层数相等,应为H或Be;B原子的最外层电子数是内层电子数的2倍,应为C元素;C元素主要化合价为-2,原子半径为66pm,应为O元素;D与A同主族,最高价氧化物对应的水化物易溶于水,则应为Na元素,且A为H元素;E原子半径为104pm,所在主族序数与所在周期序数之差为3,应为S元素;F单质为有色的气体,且原子序数最大,应为Cl元素,据此答题.
解答:
解:A、B、C、D、E、F都是短周期元素,原子序数依次增大;A原子最外层电子数和电子层数相等,应为H或Be;B原子的最外层电子数是内层电子数的2倍,应为C元素;C元素主要化合价为-2,原子半径为66pm,应为O元素;D与A同主族,最高价氧化物对应的水化物易溶于水,则应为Na元素,且A为H元素;E原子半径为104pm,所在主族序数与所在周期序数之差为3,应为S元素;F单质为有色的气体,且原子序数最大,应为Cl元素,
(1)D2C2为Na2O2,电子式为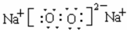 ,为离子化合物,属于离子晶体,
,为离子化合物,属于离子晶体,
故答案为: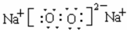 ;离子晶体;
;离子晶体;
(2)因为H2O分子之间有氢键存在,所以沸点高于硫化氢,
故答案为:>;
(3)S和Cl在同一周期,元素周期表中,从左到右元素的非金属性逐渐增强,对应单质的氧化性也逐渐增强,所以硫的非金属性弱于氯,可根据单质之间的置换反应或与变价金属反应来证明,有关的反应方程式为H2S+C12=S+2HCl(或 2Fe+3C12
2FeCl3、Fe+S
2FeS),
故答案为:弱;H2S+C12=S+2HCl(或 2Fe+3C12
2FeCl3、Fe+S
2FeS);
(4)化合物甲由A、B、C、D四种元素组成,其化学式量为84,应为NaHCO3,易与盐酸反应生成二氧化碳气体和水,反应的离子方程式为HCO3-+H+═CO2↑+H2O,
故答案为:HCO3-+H+═CO2↑+H2O.
(1)D2C2为Na2O2,电子式为
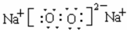 ,为离子化合物,属于离子晶体,
,为离子化合物,属于离子晶体,故答案为:
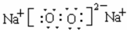 ;离子晶体;
;离子晶体;(2)因为H2O分子之间有氢键存在,所以沸点高于硫化氢,
故答案为:>;
(3)S和Cl在同一周期,元素周期表中,从左到右元素的非金属性逐渐增强,对应单质的氧化性也逐渐增强,所以硫的非金属性弱于氯,可根据单质之间的置换反应或与变价金属反应来证明,有关的反应方程式为H2S+C12=S+2HCl(或 2Fe+3C12
| ||
| ||
故答案为:弱;H2S+C12=S+2HCl(或 2Fe+3C12
| ||
| ||
(4)化合物甲由A、B、C、D四种元素组成,其化学式量为84,应为NaHCO3,易与盐酸反应生成二氧化碳气体和水,反应的离子方程式为HCO3-+H+═CO2↑+H2O,
故答案为:HCO3-+H+═CO2↑+H2O.
点评:本题考查原子结构和元素周期律的关系,题目难度不大,元素推断是解题的关键,答题时注意元素周期律的灵活运用.

练习册系列答案
相关题目
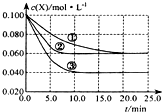 溶液中的反应:X+Y?2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如图所示.②、③与①比较只有一个实验条件不同,下列说法不正确的是( )
溶液中的反应:X+Y?2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如图所示.②、③与①比较只有一个实验条件不同,下列说法不正确的是( )| A、前5min实验③的平均反应速率最快 |
| B、条件②的反应最先达到平衡 |
| C、②与①比较可能是压强更大 |
| D、该反应的正反应是吸热反应 |
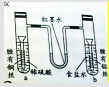 某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )
某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )| A、a、b中负极反应式均是:Fe-2e═Fe2+ |
| B、红墨水柱两边的液面变为左低右高 |
| C、a中铁钉上发生了氧化反应,b中铁钉上发生还原反应 |
| D、a中铜丝附近有气泡产生,b中有白色沉淀产生 |
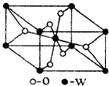 原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.
原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.