题目内容
某混合气体G可能含有CO、CO2、SO2、H2O等气体,用a.无水CuSO4、b.澄清石灰水、c.灼热CuO、d.碱石灰、e.品红溶液、f.酸性高锰酸钾溶液等药品可将其一一检出,检出的正确顺序是…( )
| A、G→a→e→b→f→d→c |
| B、G→c→d→b→e→f→a |
| C、G→a→e→f→b→d→c |
| D、G→b→e→f→a→d→c |
考点:物质的检验和鉴别的基本方法选择及应用
专题:物质检验鉴别题
分析:白色无水硫酸铜遇水变成蓝色,品红溶液检验SO2,用高锰酸钾溶液除去SO2,再通过澄清石灰水检验CO2,通过碱石灰除去二氧化碳,再通过加热的CuO检验CO,CO2和SO2顺序不能变,因为SO2也会使澄清石灰水变浑浊,以此来解答.
解答:
解:先用a检测出水,无水硫酸铜变蓝,因为后面一些步骤中会有水产生,且空气中的水蒸气可能也会影响检测结果;
再用e检测二氧化硫,二氧化硫使品红溶液褪色;
再用f将多有的二氧化硫除去(或者说检测二氧化硫是否除尽),因为如果不除尽,二氧化硫会影响后面的实验;
再用b检测二氧化碳并除去过量的二氧化碳,二氧化碳使澄清石灰水变混浊;
通过d碱石灰除去二氧化碳;
再用c来检测CO,红热氧化铜由黑色变成红色,
故选C.
再用e检测二氧化硫,二氧化硫使品红溶液褪色;
再用f将多有的二氧化硫除去(或者说检测二氧化硫是否除尽),因为如果不除尽,二氧化硫会影响后面的实验;
再用b检测二氧化碳并除去过量的二氧化碳,二氧化碳使澄清石灰水变混浊;
通过d碱石灰除去二氧化碳;
再用c来检测CO,红热氧化铜由黑色变成红色,
故选C.
点评:本题考查物质检验实验方案的设计,为高频考点,把握物质的性质及检验顺序为解答的关键,侧重元素化合物性质及实验能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关实验原理、方法和结论都正确的是( )
| A、用一定浓度的盐酸滴定氨水测定后者浓度时,加入酚酞作指示剂 |
| B、在滴加酚酞的Na2CO3 溶液中逐滴加入BaCl2溶液,红色逐渐退去,说明Na2CO3 溶液中存在水解平衡 |
| C、将等体积、等pH的盐酸和醋酸溶液分别稀释相同的倍数后,醋酸溶液的pH大 |
| D、在蒸馏水滴加H2SO4,Ka不变 |
 按如图装置进行实验,气球中装有等质量的Na2CO3与NaHCO3,试管中装有等浓度的足量的稀盐酸,把两种药品同时倒入试管中,下列说法正确的是( )
按如图装置进行实验,气球中装有等质量的Na2CO3与NaHCO3,试管中装有等浓度的足量的稀盐酸,把两种药品同时倒入试管中,下列说法正确的是( )| A、甲中气球膨胀得大 |
| B、两气球膨胀一样大 |
| C、甲中消耗的盐酸多 |
| D、乙中气球膨胀得快 |
在一密闭容器中加入A、B两种气体,保持一定温度,在t1、t2、t3、t4时刻测得各物质的浓度如下:据此下列结论中正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| C(A)/mol?L-1 | 6 | 3 | 2 | 2 |
| C(B)/mol?L-1 | 5 | 3.5 | 3 | 3 |
| C(C)/mol?L-1 | 1 | 2.5 | 3 | 3 |
| A、在容器中发生的反应为2A(g)+B(g)?2C(g) |
| B、该温度下,此反应的平衡常数为0.25 |
| C、A的转化率比B转化率的低 |
| D、在t3时刻反应已经停止 |
PCl3和PCl5都是重要的化工原料.将PCl3(g) 和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于5min时达到平衡:PCl3(g)+Cl2(g)?PCl5(g)有关数据如下下列判断不正确的是( )
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | c1 | c2 | 0.4 |
| A、若升高温度,反应的平衡常数减小,则正反应为吸热 |
| B、反应5min内,v(PCl3)=0.08 mol?L-1?min-1 |
| C、当容器中Cl2为1.2mol时,可逆反应达到平衡状态 |
| D、平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol?L-1 |
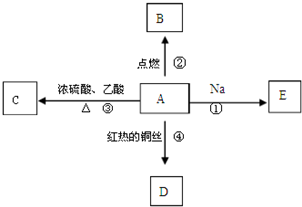 A是乙醇的同系物,其分子中只有1个甲基,相对分子质量为60,它能进行如图所示的多种反应:
A是乙醇的同系物,其分子中只有1个甲基,相对分子质量为60,它能进行如图所示的多种反应: 金属单质A和非金属单质B、C及甲、乙、丙、丁、戊五种化合物有如图所示的转化关系,甲是工业上冶炼A的主要原料,丙是一种无色无味的液体.请回答:
金属单质A和非金属单质B、C及甲、乙、丙、丁、戊五种化合物有如图所示的转化关系,甲是工业上冶炼A的主要原料,丙是一种无色无味的液体.请回答: