题目内容
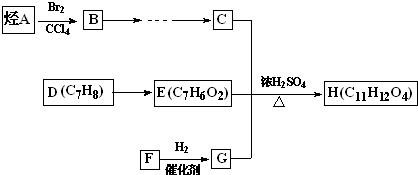
 按如图装置进行实验,气球中装有等质量的Na2CO3与NaHCO3,试管中装有等浓度的足量的稀盐酸,把两种药品同时倒入试管中,下列说法正确的是( )
按如图装置进行实验,气球中装有等质量的Na2CO3与NaHCO3,试管中装有等浓度的足量的稀盐酸,把两种药品同时倒入试管中,下列说法正确的是( )| A、甲中气球膨胀得大 |
| B、两气球膨胀一样大 |
| C、甲中消耗的盐酸多 |
| D、乙中气球膨胀得快 |
考点:探究碳酸钠与碳酸氢钠的性质
专题:几种重要的金属及其化合物
分析:等质量的NaHCO3和Na2CO3与足量稀盐酸的反应,由n=
可知,NaHCO3的物质的量大,由C原子守恒可知,NaHCO3生成气体多,且反应速率快,以此来解答.
| m |
| M |
解答:
解:等质量的NaHCO3和Na2CO3与足量稀盐酸的反应,由n=
可知,NaHCO3的物质的量大,甲中发生HCO3-+H+═CO2↑+H2O,乙中发生CO32-+2H+═CO2↑+H2O,
则甲中气球膨胀得大、且快,二者消耗盐酸分别为
×1<
×2,即乙中消耗盐酸多,
故选A.
| m |
| M |
则甲中气球膨胀得大、且快,二者消耗盐酸分别为
| m |
| 84 |
| m |
| 106 |
故选A.
点评:本题考查碳酸钠、碳酸氢钠的性质实验,为高频考点,把握实验中气球变化与反应的关系为解答的关键,注意等量的两种盐与足量酸反应时碳酸氢钠反应快且生成气体多,题目难度不大.

练习册系列答案
相关题目
已知几种阴离子还原性强弱顺序为OH-<Cl-<Br-<I-<S2-,若某溶液含有相同浓度的OH-、Cl-、Br-、I-、S2-,当向其中逐滴滴入新制的饱和氯水直至过量时,最后被氧化的离子是( )
| A、Br- |
| B、Cl- |
| C、OH- |
| D、S2- |
下列实验装置与实验操作正确的是( )


| A、①④⑥ | B、④⑥ |
| C、①②④⑤ | D、④⑤⑥ |
下列实验装置或操作能达到实验目的( )
A、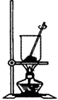 将海带灼烧成灰 |
B、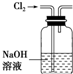 除去Cl2中混有的HCl气体 |
C、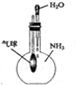 验证NH3易溶于水 |
D、 蒸干NH4Cl饱和溶液制备NH4Cl 晶体 |
某混合气体G可能含有CO、CO2、SO2、H2O等气体,用a.无水CuSO4、b.澄清石灰水、c.灼热CuO、d.碱石灰、e.品红溶液、f.酸性高锰酸钾溶液等药品可将其一一检出,检出的正确顺序是…( )
| A、G→a→e→b→f→d→c |
| B、G→c→d→b→e→f→a |
| C、G→a→e→f→b→d→c |
| D、G→b→e→f→a→d→c |
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)?3C(g),若反应开始时充入2mol A和1.5molC,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数仍为a%的是( )
| A、2 mol C |
| B、1 mol B和1 mol C |
| C、2 mol A、1 mol B |
| D、3 mol A、0.5 mol B |
向含有KCl和KI的混合溶液中加入过量的溴水充分反应.将溶液蒸干并灼烧所得的物质,最后剩余的固体物质是( )
| A、KCl |
| B、KCl和KI |
| C、KCl和KBr |
| D、KCl、KBr、I2 |