题目内容
5.常温下,下列各组离子在指定溶液中能大量共存的是( )| A. | 无色透明的溶液中:Fe3+、Mg2+、SCN -、Cl - | |
| B. | c(H+)/c(OH-)=1×10 -12的溶液中:K+、Na+、CO32-、NO3- | |
| C. | c(Fe2+ )=1 mol•L-1的溶液中:K+、NH4+、MnO4-、SO42- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3- |
分析 A.无色透明说明溶液中不含有色离子,且离子之间不反应;
B.c(H+)/c(OH-)=1×10 -12的溶液,溶液呈碱性,离子之间不反应且和氢氧根离子不反应的能大量共存;
C.能和亚铁离子反应的离子不能大量共存;
D.能使甲基橙溶液变红色,说明溶液呈酸性,离子之间不反应的能大量共存.
解答 解:A.Fe3+呈黄色,不符合无色条件,且Fe3+、SCN -发生络合反应而不能大量共存,故A错误;
B.c(H+)/c(OH-)=1×10 -12的溶液,溶液呈碱性,这几种离子之间不反应且都不和氢氧根离子反应,所以能大量共存,故B正确;
C.Fe2+、MnO4-发生氧化还原反应而不能大量共存,故C错误;
D.能使甲基橙溶液变红色,说明溶液呈酸性,HCO3-能和氢离子反应生成二氧化碳和水而不能大量共存,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,侧重考查氧化还原反应、络合反应、复分解反应,明确离子共存条件及离子性质是解本题关键,注意隐含信息的灵活运用,题目难度不大.

练习册系列答案
相关题目
1.25℃时,0.1mol/L的CH3COONa溶液的pH=a,则下列说法正确的是( )
| A. | a<7 | |
| B. | 该溶液中水电离的c(OH-)=10-amol/L | |
| C. | CH3COO-水解的百分率为$\frac{10-a}{0.1}$×100% | |
| D. | c(CH3COOH)=(l0a-14-10-a)mol/L |
2.下列能量转化过程与氧化还原反应无关的是( )
| A. | 硅太阳能电池工作时,光能转化成电能 | |
| B. | 锂离子电池放电时,化学能转化成电能 | |
| C. | 电解质溶液导电时,电能转化成化学能 | |
| D. | 葡萄糖为人类生命活动提供能量时,化学能转化成热能 |
20.下列有关化学用语表示正确的是( )
| A. | 质量数为31的磷原子:3115P | B. | 氟原子的结构示意图: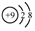 | ||
| C. | CaCl2的电子式: | D. | 明矾的化学式:Al2(SO4)3 |
1.可逆反应2A(g)→B(g)在一定条件下达平衡后,其他条件不变只把体积缩小一半,下列说法错误的是( )
| A. | 平衡正向移动 | B. | B的浓度增大 | C. | A的浓度减小 | D. | 逆反应速率加快 |
8.下列化合物中,既能发生消去反应,又能发生水解反应的是( )
| A. | 氯仿 | B. | 一氯甲烷 | C. | 一氯乙烷 | D. | 乙醇 |
5.下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的是( )

| A. | 制取SO2 | B. | 验证漂白性 | C. | 收集SO2 | D. | 尾气处理 |
11.常温下,滴有两滴酚酞试液的Na2CO3溶液中存在CO32-+H2O?HCO3-+OH-平衡,溶液呈红色.下列说法不正确的是( )
| A. | 稀释溶液,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})•c({H}^{+})}$增大 | |
| B. | 通入CO2,或者加入少量氯化铵溶液,溶液pH均减小 | |
| C. | 升高温度,红色变深,平衡常数增大 | |
| D. | 加入NaOH固体,$\frac{c(HCO_3^-)}{{c(CO_3^{2-})}}$减小 |
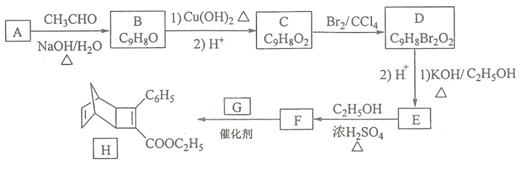
 +
+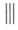 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$
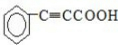 .
.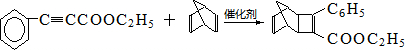 .
.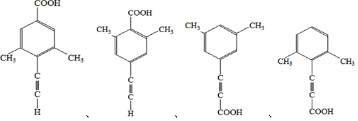 .
.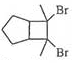 的合成路线
的合成路线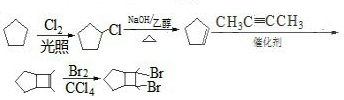 (其他试剂任选).
(其他试剂任选).