题目内容
17.已知IIA元素由上至下依次是:Be、Mg、Ca、Sr、Ba、Ra;以同主族元素及其化合物性质的相似性为依据作出的下列判断不正确的( )| A. | SrO可与盐酸反应 | B. | Sr(OH)2难溶于水 | C. | SrSO4难溶于水 | D. | Sr(OH)2是强碱 |
分析 根据第二周期到到第六周期的元素从上往下金属性增强,与水反应越容易,最高氧化物对应的水化物的溶解性增强,碳酸盐都难溶于水,由此分析解答.
解答 解:A、氧化钙与盐酸反应生成盐与水,根据同主族元素及其化合物性质的相似性,所以SrO可与盐酸反应也与盐酸反应生成相应的盐与水,故A正确;
B、氢氧化钙微溶于水,根据同主族元素及其化合物性质的相似性,所以Sr(OH)2溶解性大于氢氧化钙,而不是难溶于水,故B错误;
C、硫酸钙和硫酸钡不溶于水,根据同主族元素及其化合物性质的相似性,所以SrSO4难溶于水,故C正确;
D、氢氧化钙和氢氧化钡都是强碱,根据同主族元素及其化合物性质的相似性,所以Sr(OH)2是强碱,故D正确;
故选B.
点评 本题考查同主族元素性质的相似性和递变性,题目难度不大,本题有类推的方法思考.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
12.元素X、Y、Z的原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子排布.下列推测不正确的是( )
| A. | 同族元素中Z的氢化物稳定性最高 | |
| B. | 原子半径:X>Y,离子半径:X+>Z2- | |
| C. | 同周期元素中X的金属性最强 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
2.X元素的阳离子和Y元素的阴离子具有与氩元素相同的电子层结构.下列叙述正确的是( )
| A. | X的最高正价比Y的小 | |
| B. | X的最高价氧化物一定是X2O,Y的气态氢化物为H2Y | |
| C. | X的离子半径比Y的大 | |
| D. | X的核电荷数比Y的小 |
9.下列有关石油和煤的利用叙述不正确的是( )
| A. | 煤的干馏就是将煤隔绝空气在高温使之分解,得到焦炭、煤焦油等物质的过程 | |
| B. | 煤的液化就是将煤转化成甲醇、乙醇等其液态物质的过程 | |
| C. | 煤的气化就是将煤在高温条件由固态转化为气态的物理变化过程 | |
| D. | 通过催化裂化或裂解,可以获得碳原子数较少的轻质油 |
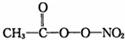 (PAN)等二次污染物.
(PAN)等二次污染物.