题目内容
10.已知相同温度下电离常数Ki(HF)>Ki(HCN).在物质的量浓度均为0.1mol/L的NaCN和NaF混合溶液中,下列关系正确的是( )| A. | c(F-)>c(OH-)>c(HCN)>c(HF) | B. | c(F-)+c(HF)>c(CN-)+c(HCN) | ||
| C. | c(OH-)>c(F-)>c(CN-)>c(H+) | D. | c(OH-)>c(HF)>c(HCN)>c(H+) |
分析 电离常数Ki(HF)>Ki(HCN),根据越弱越水解可知:c(HCN)>c(HF),再根据水解反应CN-+H2O?HCN+OH-、F-+H2O?HF+OH-、H2O?H++OH-可知:c(OH-)>c(HCN)>c(HF);在盐溶液中,阴、阳离子为主要离子,故c(F-)>c(OH-)>c(HCN)>c(HF);根据物料守恒可知:c(Na+)=c(F-)+c(HF)=c(CN-)+c(HCN),据此进行解答.
解答 解:由于电离常数Ki(HF)>Ki(HCN),根据越弱越水解可知,c(HCN)>c(HF),故D错误;
再根据水解反应CN-+H2O?HCN+OH-、F-+H2O?HF+OH-、H2O?H++OH-可知:c(OH-)>c(HCN)>c(HF);
在盐溶液中,阴、阳离子为主要离子,故c(F-)>c(OH-)>c(HCN)>c(HF),故A正确,C错误;
根据物料守恒可知:c(Na+)=c(F-)+c(HF)=c(CN-)+c(HCN),故B错误;
根据分析可知,正确的为A,
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确酸性强弱与电离平衡常数的关系为解答关键,注意掌握盐的水解原理及其影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
17.碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料.请根据题意回答下列问题:
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法.其流程如下:
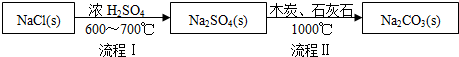
(1)流程I的另一产物是HCl,流程Ⅱ的反应分步进行:a.Na2SO4+4C $\frac{\underline{\;1000℃\;}}{\;}$ Na2S+4CO↑;
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为Na2SO4+4C+CaCO3$\frac{\underline{\;1000℃\;}}{\;}$Na2CO3+CaS+4CO↑.
Ⅱ.1862年,比利时人索尔维(Ernest Solvay)用氨碱法生产碳酸钠.反应原理如下:
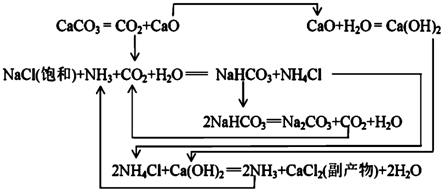
20℃时一些物质在水中的溶解度/g•(100gH2O)-1
(2)氨碱法生成纯碱的原料是食盐、石灰石、NH3,可循环利用的物质有CaO、CO2、NH4Cl、NH3.
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:反应体系中NaHCO3溶解度最小,反应消耗水,NaHCO3相对分子质量最大.
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在0~10℃(填温度范围)下析出NH4Cl.(填化学式)

Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法.其流程如下:
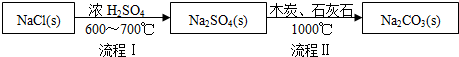
(1)流程I的另一产物是HCl,流程Ⅱ的反应分步进行:a.Na2SO4+4C $\frac{\underline{\;1000℃\;}}{\;}$ Na2S+4CO↑;
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为Na2SO4+4C+CaCO3$\frac{\underline{\;1000℃\;}}{\;}$Na2CO3+CaS+4CO↑.
Ⅱ.1862年,比利时人索尔维(Ernest Solvay)用氨碱法生产碳酸钠.反应原理如下:

20℃时一些物质在水中的溶解度/g•(100gH2O)-1
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:反应体系中NaHCO3溶解度最小,反应消耗水,NaHCO3相对分子质量最大.
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在0~10℃(填温度范围)下析出NH4Cl.(填化学式)

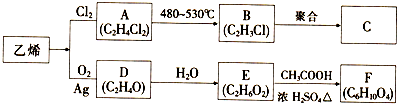
 .
.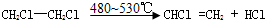 ;
;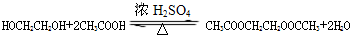 .
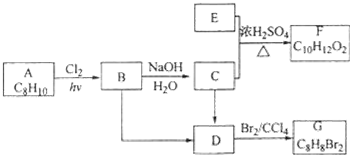
.
 .
. .
. (填结构简式)
(填结构简式)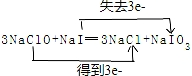 ,还原剂与氧化剂的物质的量之比是1:3.
,还原剂与氧化剂的物质的量之比是1:3.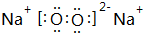 ;Z的化学式为SiO2.
;Z的化学式为SiO2.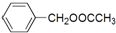 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: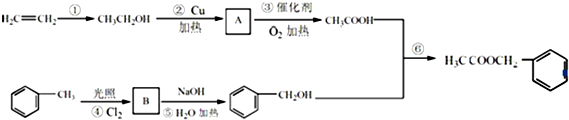
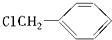 ;
;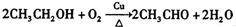 ,
,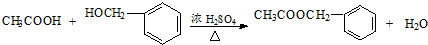 ;
;