题目内容
17.铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与11.2L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.则消耗铜的质量为( )| A. | 16 g | B. | 24 g | C. | 32 g | D. | 64g |
分析 铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、N2O4、NO2 的混合气体,这些气体与11.2L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,说明铜失去的电子给做氧化剂的硝酸,生成气体,气体和氧气全部反应生成硝酸,证明氧气得到电子和铜失去的电子相同,依据电子守恒计算得到.
解答 解:铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、N2O4、NO2 的混合气体,这些气体与11.2L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,完全生成HNO3,则整个过程中HNO3 反应前后没有变化,说明铜失去的电子给做氧化剂的硝酸,生成气体,气体和氧气全部反应生成硝酸,证明氧气得到的电子和铜失去的电子相同,即Cu失去的电子都被O2得到,
由电子守恒可知n(Cu)×2=n(O2)×4,
n(Cu)=$\frac{\frac{11.2L}{22.4L/mol}×4}{2}$=1mol,
消耗铜的质量=1mol×64g/mol=64g,
故选D.
点评 本题考查了氧化还原反应的电子守恒的计算应用,物质性质的变化和反应过程的分析是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.单斜硫和正交硫是硫的两种同素异形体
已知:①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法正确的是( )
已知:①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法正确的是( )
| A. | △H3=+0.33 kJ•mol-1 | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | △H3<0,正交硫比单斜硫稳定 | |
| D. | △H3>0,单斜硫比正交硫稳定 |
5. 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
(1)新制的绿矾(FeSO4•7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O.
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在50℃(选填“0℃、25℃、50℃”),装置Ⅱ的作用是防止产生倒吸.
②装置Ⅲ中的试剂可以是C(选填序号,下同),现象是产生白色沉淀,则证明气体产物中含有SO3; 装置Ⅳ中的试剂可以是BE.
A.2mol/LNa2CO3溶液 B.品红溶液
C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数=35.7%
(精确到0.1%)
 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.(1)新制的绿矾(FeSO4•7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O.
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在50℃(选填“0℃、25℃、50℃”),装置Ⅱ的作用是防止产生倒吸.
②装置Ⅲ中的试剂可以是C(选填序号,下同),现象是产生白色沉淀,则证明气体产物中含有SO3; 装置Ⅳ中的试剂可以是BE.
A.2mol/LNa2CO3溶液 B.品红溶液
C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液 , | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
(精确到0.1%)
9.下列有关实验操作能达到相应目的是( )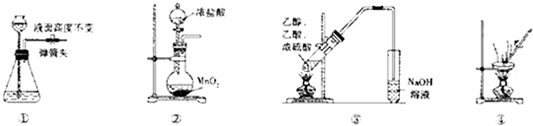

| A. | 装置①所示气密性良好 | |
| B. | 装置②可用于实脸室制取氯气 | |
| C. | 装置③可用于制取并收集乙酸乙脂 | |
| D. | 装置④可用于除去硫酸铜晶体中的结晶水 |
6.下列气态氢化物中最稳定的是( )
| A. | H2O | B. | PH3 | C. | HF | D. | NH3 |
7.下列指定反应的离子方程式正确的是( )
| A. | 向Ag(NH3)2NO3溶液中加入盐酸:Ag(NH3)2++2H+=Ag++2NH4+ | |
| B. | 向Na2O2中加入足量的水:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| C. | 向硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 向Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |

 ⑥
⑥ ⑦CH3CH2CH3
⑦CH3CH2CH3 ⑨
⑨ ⑩
⑩