题目内容
9.下列有关实验操作能达到相应目的是( )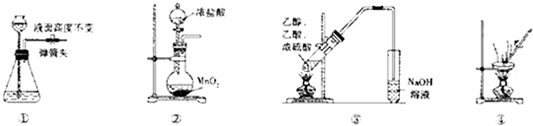
| A. | 装置①所示气密性良好 | |
| B. | 装置②可用于实脸室制取氯气 | |
| C. | 装置③可用于制取并收集乙酸乙脂 | |
| D. | 装置④可用于除去硫酸铜晶体中的结晶水 |
分析 A.关闭止水夹,利用液柱法检验气密性;
B.浓盐酸与二氧化锰反应需要加热;
C.乙酸乙酯与NaOH发生水解反应;
D.应在坩埚中加热,测定结晶水.
解答 解:A.关闭止水夹,从长颈漏斗注入水,在漏斗下端与锥形瓶中液面出现液柱法,一段时间高度不变,则气密性良好,故A正确;
B.浓盐酸与二氧化锰反应需要加热,图中缺少加热装置,故B错误;
C.乙酸乙酯与NaOH发生水解反应,试管中应为饱和碳酸钠溶液,故C错误;
D.应在坩埚中加热,测定结晶水,图中仪器不能为蒸发皿,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、物质制备实验、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.二氧化碳的捕集、利用与封存是能源领域的一个重要研究课题
(1)在太阳能作用下,以CO2为原料制取碳(C)的流程如图1所示.
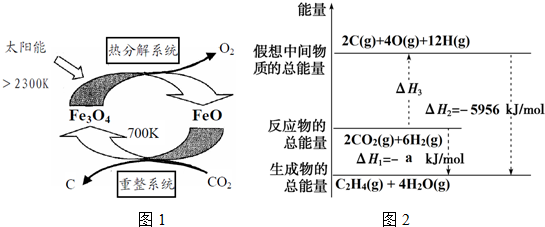
①热分解系统每分解0.5mol Fe3O4转移电子的物质的量为1mol.
②该系统的总反应的化学方程式是CO2═C+O2.
(2)二氧化碳催化加氢可合成低碳烯:
2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H1=-a kJ•mol-1,有关能量变化如图2所示:
①几种物质具有的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时放出或吸收的热量即为其具有的能量)如表所示:
则a=128
②几种化学键的键能如下:
则b=436
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图三所示.
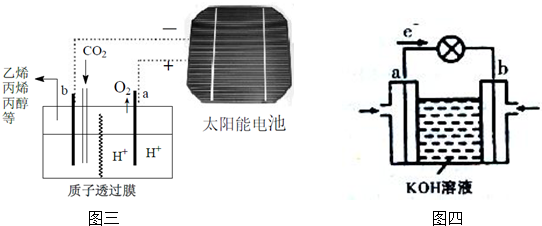
①该工艺中能量转化方式主要有太阳能转化为电能、电能转化为化学能(写出其中两种形式即可).
②其中b极上生成丙烯(CH3CH=CH2)的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
③乙烯和氧气反应通过上图四装置可将化学能转化为电能,b电极反应式为O2+2H2O+4e-=4OH-.
(1)在太阳能作用下,以CO2为原料制取碳(C)的流程如图1所示.

①热分解系统每分解0.5mol Fe3O4转移电子的物质的量为1mol.
②该系统的总反应的化学方程式是CO2═C+O2.
(2)二氧化碳催化加氢可合成低碳烯:
2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H1=-a kJ•mol-1,有关能量变化如图2所示:
①几种物质具有的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时放出或吸收的热量即为其具有的能量)如表所示:
| 物质 | CO2(g) | C2H4(g) | H2O(g) |
| 能量/kJ•mol-1 | -394 | 52 | -242 |
②几种化学键的键能如下:
| 化学键 | C=O | H-H | C=C | O-H |
| 键能/kJ•mol-1 | 803 | b | 615 | 463 |
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图三所示.

①该工艺中能量转化方式主要有太阳能转化为电能、电能转化为化学能(写出其中两种形式即可).
②其中b极上生成丙烯(CH3CH=CH2)的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
③乙烯和氧气反应通过上图四装置可将化学能转化为电能,b电极反应式为O2+2H2O+4e-=4OH-.
20.14号元素在周期表中的位置是( )
| A. | 第二周期IVA族 | B. | 第二周期VIA族 | C. | 第三周期IVA族 | D. | 第三周期VIA族 |
17.铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与11.2L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.则消耗铜的质量为( )
| A. | 16 g | B. | 24 g | C. | 32 g | D. | 64g |
14.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H<0,反应物总能量>生成物总能量 | |
| B. | 相同条件下1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
18.下列反应都是中学阶段常见的反应,从分类的角度选出不同类型的( )
| A. | 皂化反应 | B. | 焰色反应 | C. | 水解反应 | D. | 钝化反应 |
19. 已知丙~庚元素在周期表(前四周期)中的相对位置如下图,其中己的最高氧化物对应水化物有强脱水性,丁原子最外层电子数是最内层电子数的2倍.下列判断错误的是( )
已知丙~庚元素在周期表(前四周期)中的相对位置如下图,其中己的最高氧化物对应水化物有强脱水性,丁原子最外层电子数是最内层电子数的2倍.下列判断错误的是( )
 已知丙~庚元素在周期表(前四周期)中的相对位置如下图,其中己的最高氧化物对应水化物有强脱水性,丁原子最外层电子数是最内层电子数的2倍.下列判断错误的是( )
已知丙~庚元素在周期表(前四周期)中的相对位置如下图,其中己的最高氧化物对应水化物有强脱水性,丁原子最外层电子数是最内层电子数的2倍.下列判断错误的是( )| A. | 丙与戊的原子序数相差28 | |
| B. | 常温下,庚的单质能与水反应产生气体 | |
| C. | 气态氢化物的稳定性:庚<己<戊 | |
| D. | 丁的最高价氧化物可用于制造光导纤维 |
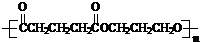 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下: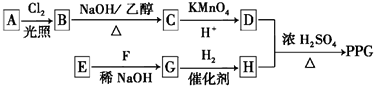
 .
.
 .
. .
. .
.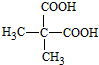 .
. .
.