题目内容
如图为浓度各为0.1mol/L的酸HA和碱BOH的溶液中,溶质分子浓度随pH值的改变而变化的情况.下列说法中不正确的是( )


| A、曲线a代表酸HA,曲线b代表碱BOH | ||
B、在0.1mol/L的BOH溶液中,但溶液的pH从8逐渐变为11时,
| ||
| C、在0.1mol/L的NaA溶液中,若通过加少量纯HA改变溶液pH时,一定有:c(Na+)-c(OH-)=c(A-)-c(H+) | ||
| D、用等物质的量浓度的NaOH溶液和盐酸分别滴定等浓度等体积的酸HA和BOH溶液时,所消耗的NaOH溶液和盐酸的体积相同 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.根据曲线中的相关数据结合酸碱性与PH间的关系进行分析解答;
B.BOH为弱碱,溶液的pH从8逐渐变为11时,碱性增强,溶质BOH浓度增大,电离程度变小;
C.根据电荷守恒分析解答;
D.依据0.05mol/LHA溶液的PH=4.7,0.05mol/L的BOH溶液的pH=9.3,酸碱电离程度相等进行解答.
B.BOH为弱碱,溶液的pH从8逐渐变为11时,碱性增强,溶质BOH浓度增大,电离程度变小;
C.根据电荷守恒分析解答;
D.依据0.05mol/LHA溶液的PH=4.7,0.05mol/L的BOH溶液的pH=9.3,酸碱电离程度相等进行解答.
解答:
解:A.0.05mol/LHA溶液的PH=4.7,说明HA为酸,0.05mol/L的BOH溶液的pH=9.3,说明BOH为碱,曲线a代表酸HA,曲线b代表碱BOH,故A正确;
B.BOH若为强碱,0.05mol/L的BOH溶液的c(H+)=
mol/L,pH=13-lg2≈12.7>9.3,说明BOH为弱碱,溶液的pH从8逐渐变为11时,碱性增强,溶质BOH浓度增大,电离程度变小,
逐渐变小,故B错误;
C.在0.1mol/L的NaA溶液中,若通过加少量纯HA改变溶液pH时,溶液中存在离子Na+、OH-、A-、H+,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),则c(Na+)-c(OH-)=c(A-)-c(H+),故C正确;
D.HA若为强酸,0.05mol/L的HA溶液的C(H+)=0.05mol/L,PH=2-lg5≈1.3<4.7,说明HA为弱酸,0.05mol/LHA溶液的PH=4.7,0.05mol/L的BOH溶液的pH=9.3,酸碱电离程度相等,所以用等物质的量浓度的NaOH溶液和盐酸分别滴定等浓度等体积的酸HA和BOH溶液时,所消耗的NaOH溶液和盐酸的体积相同,故D正确;
故选B.
B.BOH若为强碱,0.05mol/L的BOH溶液的c(H+)=
| 1×10-14 |
| 0.05 |
| C(B+) |
| C(BOH) |
C.在0.1mol/L的NaA溶液中,若通过加少量纯HA改变溶液pH时,溶液中存在离子Na+、OH-、A-、H+,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),则c(Na+)-c(OH-)=c(A-)-c(H+),故C正确;
D.HA若为强酸,0.05mol/L的HA溶液的C(H+)=0.05mol/L,PH=2-lg5≈1.3<4.7,说明HA为弱酸,0.05mol/LHA溶液的PH=4.7,0.05mol/L的BOH溶液的pH=9.3,酸碱电离程度相等,所以用等物质的量浓度的NaOH溶液和盐酸分别滴定等浓度等体积的酸HA和BOH溶液时,所消耗的NaOH溶液和盐酸的体积相同,故D正确;
故选B.
点评:本题考查酸碱溶质分子浓度随pH值的改变而变化关系,明确信息中pH及离子的关系来判断酸碱的强弱是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
如图为某含聚合物电解质薄膜的燃料电池,下列说法正确的是( )


| A、正极发生的电极反应式为:H2-2e-=2H+ |
| B、通过灯泡的电流方向是从左到右 |
| C、该聚合物电解质薄膜可通过H+的定向迁移导电 |
| D、若将灯泡换成电解饱和食盐水装置,当燃料电池生成18克水时,电解食盐水会同时产生22.4L的H2 |
下列说法中正确的是( )
| A、棉、麻、丝和毛完全燃烧都是只生成CO2和H2O |
| B、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| C、石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 |
| D、固态氨基酸主要以内盐形式存在,熔点较高,不易挥发,易溶于有机溶剂 |
X、Y、Z、W 是原子序数依次递增的四种短周期元素,甲、乙、丙、丁是它们两两组合而成的化合物,且能发生甲+乙=丙+丁的反应,乙、丙、丁的化学式分别为Y2Z、YW2、ZX4,丁的结构类似甲烷,0.1 mol?L-1 甲的水溶液pH 为1(25℃).下列说法正确的是( )
| A、原子半径:W>Z>Y>X |
| B、Y 元素在周期表中的位置为第三周期第ⅡA 族 |
| C、丁的稳定性大于甲烷 |
| D、0.1 mol?L-1 甲的水溶液中,由水电离产生的c(H+)=0.1 mol?L-1 |
下列说法不正确的是( )
| A、纸上层析法通常以滤纸作为惰性支持物,滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 |
| B、用移液管取25.00mL液体于锥形瓶中时不得将移液管下端深入锥形瓶内 |
| C、实验中不慎将苯酚沾到皮肤上,应立即用酒精洗涤,再用水冲洗 |
| D、将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
在25℃时,某醋酸钠溶液的pH为10,下列说法正确的是( )
| A、由水电离出的OH-离子浓度约为1×10-10mol/L |
| B、溶液中存在CH3COOH分子 |
| C、溶液中C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| D、溶液中加入少量醋酸pH将增大 |
关于下列各实验装置的叙述中,不正确的是( )
A、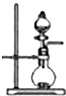 如图可用于实验室制取少量NH3或O2 |
B、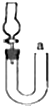 可用从a处加水的方法检验如图装置的气密性 |
C、 实验室可用如图的方法收集Cl2 |
D、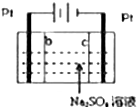 利用如图装置制硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
向含3.7g Ca(OH)2的石灰水滴加150mL 0.5mol?L-1的H3PO4溶液,待完全反应后,下列叙述正确的是( )
| A、只生成CaHPO4溶液 |
| B、有Ca3(PO4)2和CaHPO4生成 |
| C、只生成Ca(H2PO4)2溶液 |
| D、有CaHPO4和Ca(H2PO4)2生成 |