题目内容
在25℃时,某醋酸钠溶液的pH为10,下列说法正确的是( )
| A、由水电离出的OH-离子浓度约为1×10-10mol/L |
| B、溶液中存在CH3COOH分子 |
| C、溶液中C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| D、溶液中加入少量醋酸pH将增大 |
考点:盐类水解的应用
专题:盐类的水解专题
分析:A.CH3COONa溶液中C(OH-)=
;
B.溶液中存在CH3COO-水解平衡;
C.CH3COONa溶液呈碱性,则C(H+)<C(OH-);
D.加入少量CH3COOH,抑制CH3COO-水解.
| Kw |
| c(H+) |
B.溶液中存在CH3COO-水解平衡;
C.CH3COONa溶液呈碱性,则C(H+)<C(OH-);
D.加入少量CH3COOH,抑制CH3COO-水解.
解答:
解:A.CH3COONa溶液中C(OH-)=
=
mol/L=10-4mol/L,故A错误;
B.溶液中存在CH3COO-水解平衡,CH3COO-+H2O?CH3COOH+OH-,所以溶液呈存在CH3COOH,故B正确;
C.25℃时,某醋酸钠溶液的pH为10,则CH3COONa溶液呈碱性,所以C(H+)<C(OH-),故C错误;
D.加入少量CH3COOH,抑制CH3COO-水解,导致溶液中C(OH-)降低,则溶液pH减小,故D错误;
故选B.
| Kw |
| c(H+) |
| 10-14 |
| 10-10 |
B.溶液中存在CH3COO-水解平衡,CH3COO-+H2O?CH3COOH+OH-,所以溶液呈存在CH3COOH,故B正确;
C.25℃时,某醋酸钠溶液的pH为10,则CH3COONa溶液呈碱性,所以C(H+)<C(OH-),故C错误;
D.加入少量CH3COOH,抑制CH3COO-水解,导致溶液中C(OH-)降低,则溶液pH减小,故D错误;
故选B.
点评:本题考查了盐类水解,明确盐类水解特点、C(H+)及C(OH-)的计算方法即可解答,注意盐溶液、碱溶液中水电离出C(OH-)的计算方法,为易错点.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
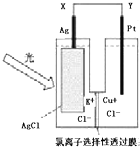 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)═AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e--→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)═AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e--→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A、光照时,电流由Y流向X |
| B、光照时,Pt电极发生的反应为2Cl-+2e-═Cl2光 |
| C、光照时,Cl-向Ag电极移动 |
| D、光照时,电池总反应为:AgCl(s)+Cu+(aq)═Ag (s)+Cu2+(aq)+Cl-(aq) |
对下列有机反应类型的认识中,不正确的是( )
A、2CH3CH2OH+O2
| |||
B、CH3COOH+CH3CH2OH
| |||
C、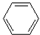 +HNO3 +HNO3
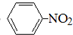 +H2O;取代反应 +H2O;取代反应 | |||
| D、CH2═CH2+Br2→CH2Br-CH2Br;加成反应 |
下列各选项所描述的两个量中,前者一定大于后者的是( )
| A、pH=3的盐酸的Cl-浓度和pH=3的醋酸溶液的CH3COO-浓度 |
| B、pH相同的氨水和醋酸钠溶液中,由水电离产生的c(H+) |
| C、0.1mol/L的盐酸和0.1mol/L的醋酸分别与金属镁反应的速率 |
| D、pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH |
如图为浓度各为0.1mol/L的酸HA和碱BOH的溶液中,溶质分子浓度随pH值的改变而变化的情况.下列说法中不正确的是( )


| A、曲线a代表酸HA,曲线b代表碱BOH | ||
B、在0.1mol/L的BOH溶液中,但溶液的pH从8逐渐变为11时,
| ||
| C、在0.1mol/L的NaA溶液中,若通过加少量纯HA改变溶液pH时,一定有:c(Na+)-c(OH-)=c(A-)-c(H+) | ||
| D、用等物质的量浓度的NaOH溶液和盐酸分别滴定等浓度等体积的酸HA和BOH溶液时,所消耗的NaOH溶液和盐酸的体积相同 |
下列排序不正确的是( )
| A、熔点:邻羟基苯甲醛>对羟基苯甲醛 |
| B、酸性:H2SO4>H2CO3>HCO3->Al(OH)3 |
| C、溶解度:Na2CO3>NaHCO3>MgCO3 |
| D、稳定性:Na2CO3>NaHCO3>H2CO3 |
下列各条件下一定能共存的离子组是( )
| A、某无色溶液中:NH4+、Na+、Cl-、MnO4- |
| B、由水电离出的c(H+)═1×10-13mol?L-1的溶液中:Na+、K+、SO42-、HCO3- |
| C、在c(H+)═1×10-13mol?L-1的溶液中:Na+、AlO2-、SO42-、NO3- |
| D、在FeSO4的溶液中:K+、Na+、Cl-、NO3- |
在下列反应中,硫酸只起催化作用的是( )
| A、乙醇和乙酸酯化 |
| B、苯的硝化反应 |
| C、乙酸乙酯水解 |
| D、乙醇在170℃时脱水生成乙烯 |
